Structure d'alcool éthylique, propriétés, utilisations, obtention
- 2173
- 629
- Prof Noah Collet
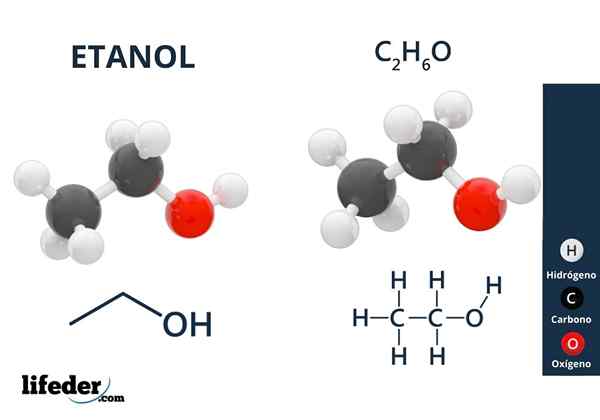
Il Alcool éthylique ou éthanol C'est un composé organique dont la formule est C2H5Oh ou ch3Ch2Oh, se présentant comme un liquide incolore. C'est le deuxième alcool primaire le plus simple de tous après le méthanol. Il est très soluble dans l'eau et dans de nombreux solvants organiques, ce qui a permis le développement de bon nombre de ses applications.
Cet alcool a été utilisé comme antiseptique et désinfectant, en plus de son utilisation dans la synthèse des médicaments et autres produits chimiques organiques. Il a également été utilisé comme carburant dans le radiateur, les lampes et en combinaison avec l'essence dans les véhicules à moteur.

La fermentation du sucre pour la production d'éthanol est l'une des premières réactions chimiques que l'homme primitif a appris. Une céramique de 9000 ans a été trouvée en Chine.
Mais la fermentation des sucres n'a produit qu'une solution d'éthanol à très faible concentration, c'est pourquoi il était nécessaire d'apprendre des techniques de distillation pour éliminer l'eau et concentrer l'alcool. Ainsi, les alchimistes grecs qui ont travaillé à Alexandrie au 1er siècle.C., Ils connaissaient et utilisaient déjà la distillation.
Cependant, il existe des voies synthétiques qui permettent d'obtenir de l'éthanol totalement pur à base d'éthylène, qui est distillé à partir de l'huile. Par conséquent, l'huile est une source indirecte d'éthanol. De cette façon, l'éthanol ou l'alcool absolu est obtenu.
[TOC]
Structure d'alcool éthylique
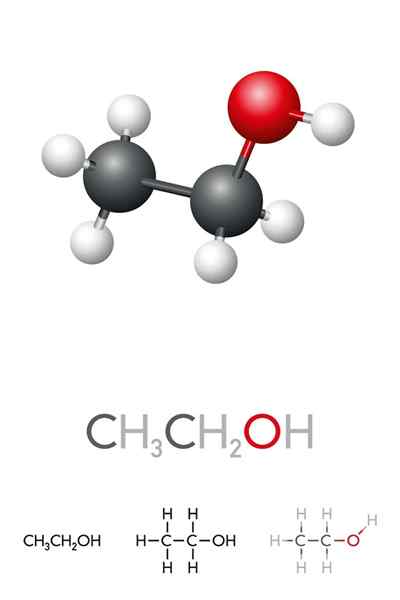
Dans l'image supérieure, nous avons la structure moléculaire de l'éthanol, CHO3-Ch2-Oh, représenté par un modèle spatial complet. C'est une moléculaire plutôt polaire, car le groupe OH attire la densité électronique vers elle-même du squelette de carbone auquel il est lié.
En conséquence, les molécules d'alcool éthylique interagissent par dipole-dipol3Ch2Oh-ohch2Ch3. C'est pourquoi cet alcool a un point d'ébullition élevé par rapport à d'autres solvants ou liquides organiques.
Propriétés
Apparence physique
Liquide incolore.
Masse molaire
46.069 g / mol
Odeur
Odeur douce et similaire au vin.
Saveur
Brûler.
Densité
0.789 g / cm3 à 20 ºC
Point de fusion
- 114.14 ºC
Point d'ébullition
78,24 ºC
Solubilité dans l'eau
1 · 106 mg / l. C'est-à-dire qu'il est pratiquement miscible dans toutes les proportions.
Discibilité avec des solvants organiques
L'éthanol est miscible avec de l'acide acétique, de l'acétone, du benzène, du tétrachlorure de carbone, du chloroforme, de l'éther Dietyl, de l'éthylène glycol, du glycérol, de la pyridine et du toluène. Il est également miscible avec des hydrocarbures aliphatiques légers, comme le pentano et l'hexano.
Coefficient de partition octanol / eau
Log p = - 0.31
La pression de vapeur
59.3 mm Hg à 25 ºC. Par conséquent, a rejeté une quantité perceptible de vapeurs.
Peut vous servir: chlorure de baryum (BACL2)Densité de vapeur
1.59 dans la relation aérienne prise comme unité (1)
point d'allumage
13 ºC
Température d'auto-direction
363 ºC
Chaleur de combustion
1336.8 kJ / mol a 25 ºC
La combustion
L'éthanol est un liquide volatil qui brûle avec une flamme bleue, sans fumée, et qui est pratiquement invisible à la lumière naturelle.
Chaleur spécifique
0.618 chaux / g à 23 ° C
Gelée
1.2 MPa · s à 20 ºC
Indice de réfraction ηd
1.3611
Utilisations de l'alcool éthylique
 L'une des utilisations les plus courantes de l'alcool est comme l'antiseptique
L'une des utilisations les plus courantes de l'alcool est comme l'antiseptique Usages médicaux
Antiseptique
L'éthanol est utilisé comme antiseptique, car il a une action mortelle contre les bactéries et les champignons. Il est capable de modifier la structure de ses membranes plasmiques, qui produit sa destruction à travers les flux d'eau osmotique qui sont établis.
De même, l'éthanol peut détruire de nombreux types de virus. À l'heure actuelle, l'utilisation de gels contenant de l'alcool pour désinfecter ses mains et réduire la contagion avec le coronavirus est recommandée. L'éthanol est également utilisé dans la désinfection des blessures mineures superficielles.
Solvant de médicament
De nombreux médicaments sont peu solubles dans l'eau, en utilisant de l'éthanol pour augmenter leur solubilité. Certaines trayons pour la toux et les rinçages en bouche ont un contemporain d'éthanol jusqu'à 25%.
Traitement de la douleur
L'éthanol est utilisé pour la lyse thérapeutique des nerfs ou des ganglions pour le soulagement de la douleur chronique intraitable, présente dans un cancer inopérable ou dans une névralgie trijumeau.
Traitement symptomatique des kystes thyroïdiens
Des injections percutanées d'éthanol sont utilisées dans le traitement des kystes thyroïdiens, une procédure simple qui pourrait éviter les complications de l'intervention chirurgicale.
Action sédative
Parfois, l'éthanol est administré par voie intraveineuse pour la sédation préopératoire et postopératoire, chez les patients auxquels d'autres mesures ne sont pas utilisables.
Antidote
L'éthanol est utilisé systémique pour le traitement de l'empoisonnement avec du méthanol ou de l'éthylène glycol.
Glaucome
L'éthanol est utilisé pour réduire la pression intraoculaire chez les patients atteints de glaucome.
Carburant
Les États-Unis, avec le Brésil, consomment 90% de l'éthanol utilisé comme carburant dans les voitures. Les États-Unis sont le plus grand producteur de maïs au monde, il utilise donc le maïs comme source d'éthanol comme carburant.
Le gouvernement a subventionné les producteurs de maïs, qui ont augmenté entre 1979 et 1986, la production d'éthanol de carburant de 20 millions de gallons par an à 750 millions de gallons.
La canne à sucre est la principale source d'éthanol au Brésil pour une utilisation comme carburant. En 1943, en raison de la Seconde Guerre mondiale.
Peut vous servir: le deutériumDepuis 1976, ils sont utilisés comme carburant dans des mélanges de voitures d'éthanol et d'essence, dont la teneur en éthanol varie entre 10 et 25%, selon la production de canne à sucre.
Utilisation récréative
L'éthanol est présent dans de nombreuses boissons utilisées lors de réunions sociales et même pendant le déjeuner et le dîner en famille.
L'action initiale de l'alcool pour désinhiber le comportement social de la personne produit un environnement agréable et facilitant l'interaction entre les gens. Cependant, l'excès d'éthanol peut faire exploser des effets toxiques et indésirables sur la santé personnelle et en harmonie entre les réunions ou les événements.
Soins personnels
L'éthanol est présent dans de nombreux produits de cosmétiques et de beauté. De plus, en raison de son action astringente, elle est utilisée dans le nettoyage de la peau, éliminant les graisses et les restes sales que l'eau et le savon ne le font pas. Cela fait également partie de la préparation de nombreuses lotions et parfums.
Nourriture
L'essence de la vanille, une saveur d'utilisation dans les gâteaux et les gâteaux, est dissoute dans un mélange d'éthanol et d'eau. Les bonbons remplis de certaines boissons alcoolisées sont vendues. L'alcool est également utilisé comme un goût de certains bonbons.
Obtenir de l'alcool éthylique
L'éthanol est principalement obtenu par la fermentation du sucre et l'hydratation de l'éthylène, répétant pour le produire à partir de dioxyde de carbone, de lipides et de cellulose.
Fermentation
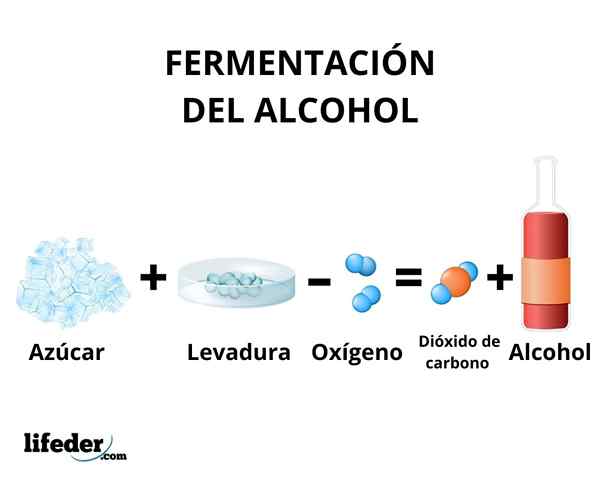
Dans le processus de fermentation, la transformation des glucides dans l'éthanol se produit par l'action des enzymes présentes dans la levure. Principalement, la canne à sucre, la betterave et les céréales telles que le maïs et l'orge sont utilisées comme matière première.
Les enzymes de la glycolyse de certaines espèces de levure, comme Saccharomyces cerevisiae, Ils sont capables d'agir sur le glucose et les sucres de saccharose, afin de produire de l'éthanol. La concentration d'éthanol produite est limitée par la sensibilité des levures à l'éthanol.
En tout cas, la concentration d'éthanol produite par la fermentation ne dépasse pas 18%. Il est nécessaire de concentrer la solution d'éthanol en utilisant une distillation simple. Grâce à cette méthode, une solution d'éthanol est obtenue avec une concentration d'environ 95%.
Enfin, une distillation fractionnée et une déshydratation d'alcool à 95% pour la production absolue d'alcool sont utilisées. L'éthanol produit par la fermentation est utilisé en médecine et est réservé comme un carburant qui complète l'essence.
Hydratation à l'éthylène
Dans ce processus, l'éthylène est mélangé à des températures élevées avec de la vapeur déionisée à des températures élevées, entre 250 et 300 ° C, et sous une pression de 6.8 MPA. La conversion de l'éthylène en éthanol est catalysée par l'acide phosphorique placé sur un lit terrestre de silice ou de diatomées.
Peut vous servir: propriétés mécaniques des métauxLa réaction d'hydratation de l'éthylène peut être schématique comme suit:
C2H4 + H2O → ch3Ch2Oh
Une partie de l'acide phosphorique est traînée par la vapeur d'eau et doit être neutralisée avec de l'hydroxyde de sodium dilué. La concentration d'éthanol obtenue par l'hydratation à l'éthylène est faible, avec une valeur comprise entre 10 et 25%.
Ensuite, la solution d'éthanol est concentrée par distillation, obtenant une solution d'éthanol à 95%, qui peut être effectuée à 100% par distillation fractionnée et déshydratation.
Autres méthodes
D'après des méthodes alternatives pour la production d'éthanol, nous avons l'utilisation de dioxyde de carbone, de lipides et de cellulose. L'utilisation de la cellulose est plus prometteuse, car des matériaux tels que le bois, la paille, les papiers des déchets, etc., comme source de matière première de cellulose. La cellulose est un polymère de glucose et peut être utilisée comme source de ce glucides.
Toxicité et risques
 Les bateaux d'alcool fait maison se trouvent généralement dans une concentration de 70% à 90%
Les bateaux d'alcool fait maison se trouvent généralement dans une concentration de 70% à 90% Inhalation
Des concentrations élevées de vapeur d'éthanol peuvent provoquer une somnolence, une irritation des yeux et des voies respiratoires supérieures, manifestées par la toux et les maux de tête.
Contact direct avec la peau et les yeux
Le contact cutané peut provoquer la sécheresse et, chronique, irritation et dermatite. Pendant ce temps, le contact visuel produit une irritation, une rougeur, une douleur et une sensation de brûlure.
Ingestion
Produit une sensation de brûlure et au début, il a une action stimulante et agréable en raison de la désinhibition produite. Mais lorsque la consommation d'alcool continue, il y a une dépression nerveuse, des maux de tête, une vision floue, une somnolence et une inconscience.
Effets chroniques
L'éthanol affecte le système nerveux central et les voies respiratoires supérieures. De plus, les lésions hépatiques causées par l'ingestion d'éthanol peuvent entraîner une cirrhose et, par la suite, la mort.
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-wesley iberoamericana.
- Wikipédia. (2020). Éthanol. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2020). Éthanol. PubChem Comunund Résumé pour CID 702. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Histoire de l'éthanol. (2011). Histoire de l'éthanol - De l'alcool au carburant de voiture. Récupéré de: éthanolhistory.com
- Les éditeurs d'Enyclopaedia Britannica. (2020). Éthanol. Récupéré de: Britannica.com
- Corquie. (15 octobre 2000). Fiche de sécurité (MSD) Alcool éthylique. [PDF]. Récupéré de: iio.Ens.UABC.mx
- Byju's. (2020). Utilisations du méthanol et de l'éthanol. Récupéré de: byjus.com
- Helmestine, Anne Marie, Ph.D. (25 août 2020). La différence entre l'alcool et l'éthanol. Récupéré de: Thoughtco.com

