Structure linéaire des Alcanos, propriétés, nomenclature, exemples

- 4902
- 1082
- Prof Ines Gaillard
Les Alcanes linéaires Ce sont des hydrocarbures saturés dont la formule chimique générale est n-CnH2n + 2. Étant des hydrocarbures saturés, toutes ses liaisons sont simples (C-H) et sont composées uniquement d'atomes de carbone et d'hydrogène. Ils reçoivent également le nom des paraffines, les différenciant des toums ramifiés auxquels ils sont appelés isoparafinas.
Ces hydrocarbures manquent de ramifications et de bagues. Plus que les lignes, cette famille de composés organiques ressemble à des chaînes plus (alcane à chaîne droite); ou sous un angle culinaire à la spaghettis (cru et cuit).
 Si les spaghettis bruts étaient moins fragiles, ils auraient une similitude encore plus étroite avec les alcanes linéaires. Source: Pixabay.
Si les spaghettis bruts étaient moins fragiles, ils auraient une similitude encore plus étroite avec les alcanes linéaires. Source: Pixabay. Les spaghettis bruts viennent représenter l'état idéal et isolé des alcanes linéaires, bien qu'avec une tendance prononcée à se briser; Tandis que les cuits, qu'ils approchent ou non de leur état naturel et synergique: certains interagissent avec les autres dans un tout (le plat de pâtes, par exemple).
Ces types d'hydrocarbures se trouvent naturellement dans les gisements de gaz naturel et de pétrole. Les plus légers ont des caractéristiques lubrifiantes, tandis que les lourdes se comportent comme un asphalte indésirable; Soluble, cependant, dans les paraffines. Ils servent très bien comme solvants, lubrifiants, carburants et asphalte.
[TOC]
Structure des alcanes linéaires
Groupes
Il a été mentionné que la formule générale de ces alcanes est CnH2n + 2. Cette formule est la même en fait pour tous les alcanes, qu'ils soient linéaires ou ramifiés. La différence alors dans le n- qui précède la formule Alcano, dont la dénotation signifie "normale".
Il sera vu plus tard que ça n- Il n'est pas nécessaire pour les alcanes avec un nombre de carbone égal ou inférieur à quatre (n ≤ 4).
Une ligne ou une chaîne ne peut pas consister en un seul atome de carbone, donc le méthane est exclu pour l'explication (ch4, n = 1). Si n = 2, nous avons l'éthane, Cho3-Ch3. Notez que cet alcane se compose de deux groupes méthyle, CHO3, lié les uns aux autres.
En augmentant le nombre de carbones, n = 3, le propane alcane est obtenu, CHO3-Ch2-Ch3. Maintenant, un nouveau groupe apparaît, Cho2, appelé méthylène. Peu importe la taille de l'alcane linéaire, vous n'aurez toujours rien de plus: Cho3 et ch2.
Peut vous servir: iterbio: structure, propriétés, utilisations, obtentionLongueurs de leurs chaînes
Lorsque le nombre de carbones de l'alcane linéaire augmente, il y a une constante dans toutes les structures résultantes: le nombre de groupes de méthylène augmente. Par exemple, supposons des alcanes linéaires avec n = 4, 5 et 6:
Ch3-Ch2-Ch2-Ch3 (n-butane)
Ch3-Ch2-Ch2-Ch2-Ch3 (n-Pentano)
Ch3-Ch2-Ch2-Ch2-Ch2-Ch3 (n-hexane)
Les chaînes deviennent plus longues parce qu'elles ajoutent à leurs groupes de structures2. Ainsi, un alcanane linéaire étendu ou court diffère le nombre de cho2 sépare les deux groupes terminaux ch3. Tous ces alcanes n'ont rien plus deux3: Au début de la chaîne et à la fin du même. Si j'en avais plus, cela impliquerait la présence de ramifications.
De même, l'absence totale de groupes CH peut être vue, présente uniquement dans les ramifications ou lorsqu'il y a des groupes substituants liés à l'un des carbones de la chaîne.
La formule structurelle peut être résumé comme suit: ch3(Ch2)N-2Ch3. Essayez de l'appliquer et de l'illustrer.
Conformations
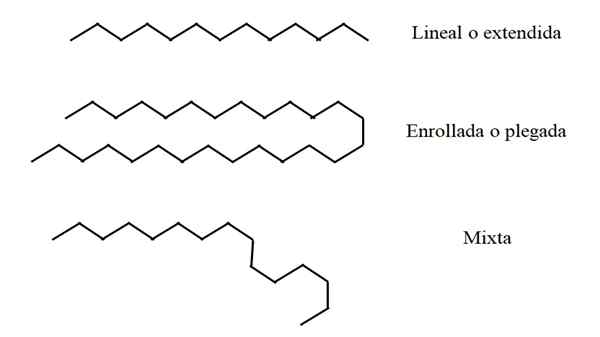 Conformations structurelles des alcanes linéaires. Source: Gabriel Bolívar.
Conformations structurelles des alcanes linéaires. Source: Gabriel Bolívar. Certains alcanes linéaires peuvent être plus longs ou plus courts que d'autres. Ainsi, n peut avoir une valeur de 2 à ∞; c'est-à-dire, une chaîne composée infinie groupe CH2 et deux groupes CH3 terminaux (en théorie est possible). Cependant, toutes les chaînes ne "peuvent pas" de la même manière dans l'espace.
C'est là que surviennent les conformations structurelles des alcanes. Ce qu'ils doivent? À la rotabilité des liens C-H et à la flexibilité de la même. Lorsque ces liens tournent ou pourrissent.
Linéaire
Dans l'image supérieure, par exemple, une chaîne de treize carbones qui reste linéaire ou étendue est indiquée dans la partie la plus élevée. Cette conformation est idéale, car on suppose que l'environnement moléculaire minimise la disposition spatiale des atomes de chaîne. Rien ne la dérange et n'a pas besoin de se pencher.
Il peut vous servir: propylène glycol: structure, propriétés, synthèse et utilisationsRoulé ou plié
Au milieu de l'image, la chaîne de carbone de vingt-sept ans subit une perturbation externe. La structure, pour être plus "confortable", fait pivoter ses liens de telle manière qu'il se replie sur lui-même; comme un long spaghetti.
Des études de calcul ont montré que le nombre maximum de carbones qu'une chaîne linéaire peut avoir est n = 17. De n = 18, il est impossible pour lui de ne pas commencer à se plier ou à rouler.
Mixte
Si la chaîne est très longue, il peut y avoir des régions qui restent linéaires tandis que d'autres ont été pliés ou inscrits. De tous, c'est peut-être la conformation la plus proche de la réalité.
Propriétés
Physique
Étant des hydrocarbures, ils sont en essence apolaire, et donc hydrophobe. Cela signifie qu'ils ne peuvent pas être mélangés avec de l'eau. Ils sont peu denses parce que leurs chaînes laissent trop d'espaces vides entre eux.
De plus, leurs états physiques vont de la soude (pour n < 5), líquidos (para n < 13) o sólidos (para n ≥ 14), y dependen de la longitud de la cadena.
Interactions
Les molécules des alcanes linéaires sont apolaires, et par conséquent, leurs forces intermoléculaires sont du type de dispersion de Londres. Les chaînes (adoptant probablement une conformation mixte) sont ensuite attirées par l'action de leurs masses moléculaires et les dipôles instantanés de leurs atomes d'hydrogène et de carbone.
C'est pour cette raison que lorsque la chaîne devient plus longue, et donc plus lourde, ses points d'ébullition et sa fusion augmentent de la même manière.
La stabilité
Plus la chaîne est longue, plus elle est instable. Habituellement, ils subissent des ruptures de leurs liens pour provoquer des chaînes plus petites d'un grand. En fait, ce processus est connu comme Craqueo, Très utilisé dans le raffinage d'huile.
Nomenclature
Pour nommer les alcanes linéaires, il suffit d'ajouter l'indicateur n- avant le nom. Si n = 3, comme c'est le cas avec le propane, il est impossible pour cet alcane de présenter une branche:
Peut vous servir: composés inorganiquesCh3-Ch2-Ch3
Chose qui ne se produit pas de n = 4, c'est-à-dire avec le n-blutane et les autres alcanes:
Ch3-Ch2-Ch2-Ch3
SOIT
(Ch3)2Ch-ch3
La deuxième structure correspond à l'isobutane, qui se compose d'un isomère structurel du butane. Pour différencier l'un de l'autre, l'indicateur n entre en jeu-. Ainsi, le n-Butano se réfère uniquement à l'isomère linéaire, sans ramifications.
Plus le N est élevé, plus le nombre d'isomères structurels est élevé et plus la plus grande importance devra utiliser n- pour se référer à l'isomère linéaire.
Par exemple, l'octane, C8H18 (C8H8 × 2 + 2), présente jusqu'à treize isomères structurels, car de nombreuses ramifications sont possibles. L'isomère linéaire, cependant, est nommé: n-Octane, et sa structure est:
Ch3-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch3
Exemples
Ils sont mentionnés ci-dessous et pour mettre fin à certains alcanes linéaires:
-Etano (c2H6): Ch3Ch3
-Propane (c3H8): Ch3Ch2Ch3
-n-Heptano (c7H16): Ch3(Ch2)5Ch3.
- n-Dean (CdixH22): Ch3(Ch2)8Ch3.
-n-Hexadécano (c16H3. 4): Ch3(Ch2)14Ch3.
-n-Non-adecan (c19H40): Ch3(Ch2)17Ch3.
-n-Eicosan (cvingtH42): Ch3(Ch2)18Ch3.
- n-Hectane (c100H202): Ch3(Ch2)98Ch3.
Les références
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. (5e édition). Éditorial Addison-Wesley Inter-American.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- Jonathan M. Homme bon. (1997). Quel est le long alcane non ramifié avec la conformation minimale globale linéaire? J. Chem. Infirme. Calcul. SCI. 1997, 37, 5, 876-878.
- García Nissa. (2019). Que sont les alcanes? Étude. Récupéré de: étudier.com
- M. Kevin A. Boudeaux. (2019). Alcanes. Récupéré de: Angelo.Édu
- Liste des alcènes à chaîne droite. [PDF]. Récupéré de: Laney.Édu
- Helmestine, Anne Marie, Ph.D. (7 septembre 2018). Nommez les 10 premiers alcanes. Récupéré de: Thoughtco.com
- Science excentrique. (20 mars 2013). Alcanes à chaîne droite: prédire les propriétés. Récupéré de: Quirkyscience.com
- Wikipédia. (2019). Alcanes plus élevés. Récupéré de: dans.Wikipédia.org
- « Dérivé du calcul de la cotangente, de la démonstration, des exercices
- Cyclopentanoperhydofenantreno Structure et importance »

