Agence de sulfite de Bismuth, préparation et utilisations
- 1170
- 14
- Raphaël Meyer
Il gélose au sulfite de bismuth Il s'agit d'un moyen de culture solide, sélectif et différentielle, spécialement formulé pour l'isolement de Salmonella enterica subgrupo enterica typhi seretypo, Entre autres espèces de salmonelles. L'environnement est connu sous le nom de BSA dans la gélose du sulfite de bismuth anglais.
La formule d'agar de sulhite de bismuth d'origine a été créée en 1927 par Wilson et Blair (milieu de fer sulfite de bismuth de glucose); Cela contenait du sulfite de sodium, du glucose, de la solution de bismuth, du citrate d'ammonium, du sulfate ferreux et de l'agar.
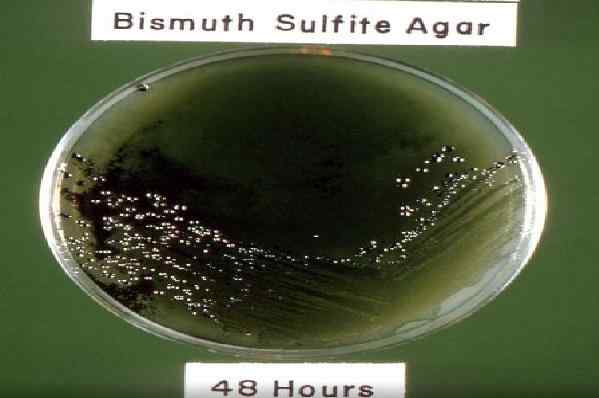
 48 -Hour Croissance de l'incubation Salmonella SP dans la gélose du sulfite de bismuth. Source: pixnio.com auteur: Dr. W. R. Erving, USCDCP
48 -Hour Croissance de l'incubation Salmonella SP dans la gélose du sulfite de bismuth. Source: pixnio.com auteur: Dr. W. R. Erving, USCDCP De nos jours, il y a une modification du milieu d'origine, composé d'extrait de viande, de peptones de viande et de caséine, indicateur de sulfite de bismuth, glucose, phosphate de disodium, sulfate ferreux, vert vif et agar-agar.
Il existe de nombreux moyens pour l'isolement des espèces de Salmonella, mais en ce qui concerne la récupération du sérotype de Typhi, la gélose du sulfite de bismuth présente un avantage remarquable sur eux, car en majorité, une récupération très faible ou zéro de ce micro-organisme est obtenue.
Cependant, il est nécessaire d'utiliser plus d'un type de milieu en matière d'isolement entéropathogène, car la gélose du sulfite de bismuth est moins efficace pour d'autres espèces de Salmonella et pour le genre Shigella, qui sont inhibées ou se développent très mal dans cette gélose.
Il convient de noter que de toutes les espèces de Salmonella, le sérotype de Typhi est l'un des entéropathogènes les plus importants de l'humain, ce qui est son seul réservoir. Cette sérovariété produit de la fièvre typhoïde, de la gastro-entérite, de la bactériémie et de la septicémie.
Pour cette raison, il est pertinent d'inclure cette gélose lorsque des échantillons d'eau, de excréments ou d'aliments sont analysés lorsque votre présence est suspectée.
[TOC]
Base
Comme la plupart des milieux de culture, l'agar du sulfite de bismuth contient des substances nutritionnelles pour favoriser le développement bactérien, comme les peptones et l'extrait de viande. De même, le glucose fonctionne comme une source d'énergie et de carbone.
Peut vous servir: éléments biogénétiquesMaintenant, toutes les bactéries ne grandiront pas dans ce milieu, car la gélose du sulfite de bismuth est un milieu sélectif. Cela contient des composés qui inhibent la croissance des micro-organismes gram positifs et certaines bactéries gram négatives. Ces composés sont: l'indicateur de sulfite de bismuth et le vert vif.
D'un autre côté, le phosphate de disodium maintient l'osmolarité et le pH du milieu.
De plus, la gélose du sulhite de bismuth est un milieu différentiel grâce à la présence de sulfate ferreux, qui montre la formation de H2S. Le H2S formé par des bactéries réagit avec le sulfate ferreux et forme un précipité insoluble clairement visible.
Enfin, Agar -Agar fournit une solide cohérence à l'environnement.
préparation
Peser 52,3 gr du milieu déshydraté et se dissoudre dans un litre d'eau. Chauffer pour faire bouillir le mélange pendant 1 minute avec une agitation fréquente, jusqu'à sa dissolution totale. Ne surchauffez pas trop. Ce milieu n'est pas stérilisé dans l'autoclave, car la chaleur extrême endommage le milieu de culture.
Laisser refroidir à 45 ° C et secouer avant de servir sur des plaques stériles de Petri. Il est recommandé de faire des assiettes avec une bonne épaisseur. Pour cela, 25 ml doivent être versés dans chaque plaque. Laisser solidifier. Comme c'est un moyen qui n'est pas stérilisé, il est normal que son utilisation immédiate soit suggérée.
Cependant, une étude de D'Aust en 1977, a montré qu'il y avait une meilleure récupération de Salmonella typhimurium et Salmonella enteritidis En tant qu'âge du sulfite de bismuth, la performance des sérovaires n'est pas affectée Typhi et Parathyphi b.
D'Aous recommande d'utiliser les plaques pour le jour 4 du refroidissement, bien qu'il avertit qu'à mesure que les moyens vieillissent, la sélectivité diminue, développant des souches plus facilement de Proteus vulgaris.
C'est pourquoi, pour des échantillons très pollués, comme les excréments, il est préférable d'utiliser le support nouvellement préparé. Sinon, utilisez le jour 4 de sa préparation. D'autres auteurs recommandent d'utiliser les assiettes le lendemain de leur préparation, stockée en réfrigération.
Peut vous servir: uracile: structure, fonctions, propriétés, synthèseLes plaques réfrigérées doivent être tempérées avant d'utiliser. Le pH moyen doit être de 7,5 ± 0,2. La couleur du milieu non rémunéré est beige et préparée est Opalescente Greenâtre Grey.
Applications
Parmi les échantillons qui peuvent être semés dans ce milieu figurent des échantillons de selles, des eaux de consommation ou de la nourriture et de la nourriture.
Pour améliorer les isolats, il est recommandé d'effectuer un traitement pré-enrichissant avec du bouillon de lactose et après enrichissement avec du bouillon de tétration ou de la cystine du bouillon de sélénito, avant de semer dans la gélose du sulhite de bismuth.
Les plaques sont incubées à 35 ° C ± 0,2 pendant 24 à 48 heures, en aérobiose.
Caractéristiques des colonies dans la gélose du sulfite de bismuth
Les colonies de Salmonella typhi Ils sont généralement vus dans cette gélose en 24 heures avec un centre noir et entourés d'un halo vert vif. Tandis que dans 48 heures, le noir tourne complètement en raison de la formation de sulfure d'hydrogène.
Salmonella parathyphi a présente les colonies avec des caractéristiques variables. Après 18 heures d'incubation, des colonies noires, vertes ou transparentes peuvent être observées, avec apparence mucoïde. Tandis que, à 48 heures, ils sont observés complètement noirs et parfois avec une luminosité métallique prononcée.
S. Parathyphi a Il a tendance à blacasser le milieu autour de la colonie.
Salmonella SP Merons noirs ou Grayercolonias, avec ou sans métalliser, peut devenir la surface ou non.
Les souches de coliformes, généralement, sont totalement inhibées, mais si elles se développent, elles se développent sous forme de colonies vertes ou brunes opaques et de luminosité métallique. Ne teint pas le médium autour de la colonie.
Limitation
-Les inoculums très faibles peuvent provoquer des colonies de Salmonella typhi vert clair, passant inaperçu et signalant la culture comme négative.
Peut vous servir: branches de la physiologie- L'agar du sulfite de bismuth peut inhiber la récupération de certaines espèces de Salmonella telles que S. Sendai, s. Berta, S. Gallinarum, s. abortus-equi.
-Ce milieu inhibe la plupart des espèces du genre Shigella.
- S. Typhi et S. Arizonae Ils peuvent donner des colonies très similaires.
-Les coliformes produits par H2S tels que Proteus et Citrobacter produisent des colonies similaires à celles de Salmonella, il est donc nécessaire d'effectuer des tests d'identification biochimique.
-Une bonne estria doit être faite pour obtenir des colonies isolées; C'est le seul moyen d'observer les caractéristiques typiques des colonies du genre Salmonella.
Contrôle de qualité
Pour le contrôle de la stérilité, une plaque est incubée sans inoculation à 37 ° C, on s'attend à ce qu'il n'y ait pas de croissance ou de changement de couleur.
Pour un contrôle de qualité, vous pouvez semer des souches connues telles que:
Escherichia coli ATCC 25922, Salmonella enteritidis ATCC 13076, Salmonella typhi ATCC 19430, Shigella flexneri ATCC 12022, Enterococcus faecalis ATCC 29212.
Il est prévu que Escherichia coli et Shigella flexneri sont partiellement inhibés respectivement en développement de la création verdâtre et brun brun. Tandis que les deux salmonglars doivent avoir un excellent développement avec des colonies noires avec une luminosité métallique, et enfin Enterococcus faecalis doit être totalement inhibé.
Les références
- Wilson, W., & E. M. MCV. Blair. Utilisation d'un milieu de fer sulfite de bismuth de glucose pour l'isolement de B. Typhosus et B. Protéus. Le Journal of Hygiène, 1927; 26(4), 374-391. Récupéré de .Jstor.org
- D'Aust Jy. Effet des conditions de stockage de la performance de la gélose du sulfite de bismuth. J Clin Microbiol. 1977; 5 (2): 122-124. Disponible en: NCBI.NLM.NIH.Gouvernement
- Laboratoires IVD. Agar de bismuth-sulfite selon Wilson-Blair. 2009. Disponible sur: bismuthsulfitagar_span_jan_2009% 20 (2).Pdf
- Laboratoires Himedia. Gélose au sulfite de bismuth. 2017. Disponible sur: himediaBs.com
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique de Bailey & Scott. 12 ed. Pan -American Editorial S.POUR. Argentine.
- Morales R, de La Cruz D, Leyva G et Ybarra M. Qualité bactériologique du lait de chèvre cru produit à Miravalles, Puebla. Rev Mex of Ing Chem 2012; 11 (1): 45-54
- « Farine de maïs. Fondation, préparation et utilisation
- William James Sidis l'homme le plus intelligent de l'histoire? »

