Caractéristiques d'adénilato ciclasa, types, fonctions
- 1162
- 31
- Justine Charpentier
La Adénylate de cyclasa soit adénylciclase C'est l'enzyme responsable de la conversion de l'ATP, une molécule à haute énergie, en ampli cyclique, une molécule de signalisation importante qui active diverses protéines AMP dépendant du cyclique avec des fonctions physiologiques importantes.
Son activité est contrôlée par divers facteurs tels que l'action concertée des hormones, des neurotransmetteurs et d'autres molécules de régulation de nature différente (ions calcium divalents et protéines G, pour n'en nommer que quelques-uns).
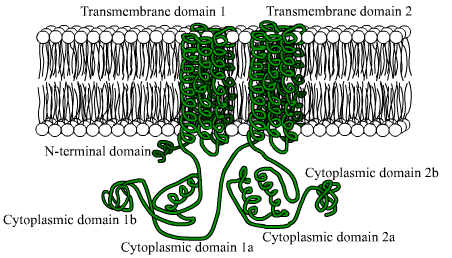
 Diagramme d'adénylate de cyclasa (source: utilisateur BensAccount sur.Wikipedia [domaine public] via Wikimedia Commons)
Diagramme d'adénylate de cyclasa (source: utilisateur BensAccount sur.Wikipedia [domaine public] via Wikimedia Commons) La principale importance de cette enzyme réside dans la transcendance du produit de la réaction qui catalyse, l'ampli cyclique, car il participe au contrôle de nombreux phénomènes cellulaires liés au métabolisme et au développement, ainsi qu'à la réponse à différents stimuli externes.
Dans la nature, à la fois des organismes unicellulaires (relativement simples) et des animaux multicellulaires grands et complexes, utilisent l'ampli cyclique comme deuxième messager, et donc aux enzymes qui le produisent.
Des études phylogénétiques établissent que ces enzymes dérivent d'un ancêtre commun avant la séparation des eubactéries et des eucaryotes, ce qui suggère que l'ampli cyclique avait des fonctions différentes, peut-être liées à la production d'ATP.
Il est possible d'accepter une telle déclaration, car la réaction catalysée par l'adénilate cyclase est facilement réversible, ce qui peut être remarqué dans la constante d'équilibre pour la synthèse de l'ATP (Kégaliseur ≈ 2.1 ± 0.2 10-9 M2).
[TOC]
Caractéristiques et structure
La plupart des enzymes d'adénylate cyclastique eucaryote sont associées à la membrane plasmique, mais dans les bactéries et dans les spermatozoïdes de mammifères, ils se trouvent comme des protéines solubles dans le cytosol.
Chez les levures et certaines bactéries sont des protéines membranaires périphériques, tandis que dans certaines espèces d'amiba, ce sont des molécules avec un seul segment transmembranal.
Caractéristiques structurelles
Ce sont des protéines composées de grandes chaînes polypeptidiques (de plus de 1.000 déchets d'acides aminés), qui traversent la membrane plasmique 12 fois au moyen de deux régions composées de six domaines transmembranaux de conformation alpha.
Chaque région transmembranale est séparée par un grand domaine cytosolique, qui est responsable de l'activité catalytique.
Peut vous servir: flore et faune d'Afrique: espèces représentativesParmi les organismes eucaryotes, il y a quelques raisons préservées dans un fragment de la région terminale amino de ces enzymes, ainsi qu'un domaine cytoplasmique d'environ 40 kDa, qui est délimité par les sections hydrophobes.
Site catalytique
La réaction que ces enzymes catalysent, c'est-à-dire la formation d'une liaison avec des personnes à la diète par une attaque nucléophile du groupe OH en position 3 'dans le groupe phosphate du trphosphate nucléoside en position 5', dépend d'un motif structurel commun connu sous le nom de le nucléoside trphosphate en position 5 ', dépend d'un motif structurel commun connu sous le nom de la Palme de domaine ".
Ce domaine de "Palma" est composé d'une raison "βαβαβ"(" Β "voulant désigner les feuilles completées β et" α "dans les hélices alpha) et a deux résidus d'acide asparable invariables qui coordonnent les deux ions métalliques responsables de la catalyse, qui peuvent être des ions de magnésium ou de magnésium divalents zincs.
De nombreuses études liées à la structure quaternaire de ces enzymes ont révélé que leur unité catalytique existe comme dimère dont la formation dépend des segments transmembranaux, qui sont recueillis dans le réticulum endoplasmique pendant la formation de la protéine.
Emplacement
Se ha determinado que al igual que muchas proteínas integrales de membrana, como el caso de las proteínas G, aquellas con anclas de fosfatidilinositol y muchas otras, las adenilciclasas se encuentran en regiones o micro dominios especiales de membrana conocidos como “balsas lipídicas” (del Anglais "Radeau lipidique").
Ces domaines membranaires peuvent avoir jusqu'à des centaines de nanomètres de diamètre et sont principalement composés de cholestérol et de sphingolipides avec des chaînes d'acides gras à prédominance et une grande longueur, ce qui les fait avoir moins de fluidité et permettre l'adaptation des segments transmembranaux de différentes protéines et de.
Les adélites de cyclasas se sont également retrouvés associés à des sous-régions de radeaux lipidiques appelés "cavéoles" (anglais "Cavéoles "), qui sont plutôt des invaginations de la membrane riche en cholestérol et une protéine associée à celle qui s'appelle cavéoline.
Gars
De nature, il existe trois types d'adénylate de cyclasses bien définis et deux qui sont actuellement soumis à la discussion.
Peut vous servir: oxihemoglobine: caractéristiques, structure et courbe d'union- Classe I: Ils sont présents dans de nombreuses bactéries négatives telles que ET. coli, Par exemple, lorsque le produit de l'ampli cyclique de la réaction a des fonctions telles que le ligand pour les facteurs de transcription responsables de la régulation des opérats cataboliques.
- Classe II: Ils se trouvent dans certains agents pathogènes des genres de bactéries telles que Bacille soit Bordetella, où ils servent de toxines extracellulaires. Ce sont des protéines activées par la calmoduline de l'hôte (absente dans les bactéries).
- Classe III: Ils sont connus comme la classe "universelle" et sont liés phylogénétiquement aux cyclasas Guanilaato, qui remplissent des fonctions similaires. Ils se trouvent dans les procaryotes et les eucaryotas, où ils sont réglementés par différentes routes.
Adénylate mammifère cyclasas
Chez les mammifères, au moins neuf types de ces enzymes ont été clonés et décrits.
Ceux-ci partagent des structures complexes et des topologies membranaires, ainsi que des domaines catalytiques en double qui en sont caractéristiques.
Pour les mammifères, la nomenclature utilisée pour se référer aux isoformes correspond aux lettres AC (par Adénylate de cyclasa) et à un nombre de 1 à 9 (AC1 - AC9). Deux variantes de l'enzyme AC8 ont également été signalées.
Les isoformes présentes chez ces animaux sont une contrepartie concernant la séquence de la structure primaire de leurs sites catalytiques et la structure à trois dimensions. L'inclusion de l'une de ces enzymes dans chaque "type" est principalement liée aux mécanismes de régulation qui fonctionnent sur chaque isoforme.
Ils ont des modèles d'expression qui sont souvent spécifiques aux tissus. Dans le cerveau, vous pouvez trouver toutes les isoformes, bien que certaines soient limitées à des zones spécifiques du système nerveux central.
Les fonctions
La fonction principale des enzymes appartenant à la famille des adénylates Cylasa est de transformer l'ATP en ampli cyclique et pour cela, ils catalysent la formation d'une liaison diète intramoléculaire 3 '- 5' (réaction similaire à celle catalysée par les polymérases d'ADN), avec la libération d'une molécule de pyrophosphate.
Chez les mammifères, les différentes variantes pouvant être réalisées ont été liées à la prolifération cellulaire, à la dépendance à l'éthanol, à la plasticité synaptique, à la dépendance aux médicaments, au rythme circadien, à la stimulation olfactive, à l'apprentissage et à la mémoire.
Peut vous servir: parasitisme: concept, types et exemplesCertains auteurs ont déclaré que l'adénylate de cyclasas peut avoir une fonction supplémentaire telle que les molécules de transport ou, ce qui est identique, les protéines de canal et les convoyeurs ioniques.
Cependant, ces hypothèses n'ont été prouvées que en fonction de la disposition ou de la topologie des segments transmembranaux de ces enzymes, qui partage certaines homologies structurelles ou similitudes (mais pas la séquence) avec certains canaux de transport ionique.
L'ampli cyclique et l'IPP (pyrophosphate), qui sont les produits de la réaction, ont des fonctions au niveau cellulaire; Mais son importance dépend de l'organisme où ils sont.
Régulation
La grande diversité structurelle entre les adénylciclasses démontre une grande sensibilité à plusieurs formes de régulation, ce qui leur permet de s'intégrer dans une variété de voies de signalisation cellulaire.
L'activité catalytique de certaines de ces enzymes dépend des alpha-cétoacides, tandis que d'autres ont des mécanismes de régulation beaucoup plus complexes qui impliquent des sous-unités régulatrices (par stimulation ou inhibition) qui dépendent, par exemple, du calcium et d'autres facteurs généralement solubles, ainsi que d'autres protéines.
De nombreux adénulats de cyclasas sont régulés négativement par des sous-unités de certaines protéines G (inhiber leur fonction), tandis que d'autres exercent plutôt des activateurs.
Les références
- Cooper, D. M. F. (2003). Régulation et organisation d'adénylyl cyclasses et de camp. Journal biochimique, 375, 517-529.
- Cooper, D., Mons, n., & Karpen, J. (Année mille neuf cents quatre-vingts-quinze). Adénylyl cyclases et interaction entre le calcium et le sigalage du camp. Nature, 374, 421-424.
- Danchin, un. (1993). Phylogénie de l'adénylyl cyclasses. Progrès dans la deuxième recherche de messager et de phosphoprotéine, 27, 109-135.
- Hanoune, J., & Reporter, n. (2001). Régulation et rôle des isoformes d'adénylyl cyclase. Ann. Tour. Pharmacol. Toxique., 41, 145-174.
- Border, u., & Schultz, J. ET. (2003). La classe III Adénylyl Cyclasses: modules de signalisation polyvalents. Signalisation cellulaire, quinze, 1081-1089.
- Tang, W., & Gilman, à. g. (1992). Adénylyl cyclases. Cellule, 70, 669-672.
- « Diffraction du son en quoi il consiste, exemples, applications
- Contexte de l'Alliance Santa, objectifs, conséquences »

