50 exemples d'acides et de bases

- 3761
- 876
- Prof Noah Collet
Il y a des centaines Exemples d'acides et de bases Cela peut être trouvé dans toutes les branches de la chimie, mais que dans son ensemble, ils sont séparés en deux grandes familles: inorganique et organique. Les acides inorganiques sont généralement connus sous le nom d'acides minéraux, caractérisés par un être particulièrement fort par rapport à l'organique.
Les acides et les bases sont compris comme des substances qui ont des saveurs agritiques ou des saponáceos, respectivement. Les deux sont corrosifs, bien que le mot «caustique» soit généralement utilisé pour des bases fortes. Dans les comptes sommaires: ils brûlent et courent la peau s'ils le touchent. Ses caractéristiques dans Solvent Media ont programmé une série de définitions à travers l'histoire.
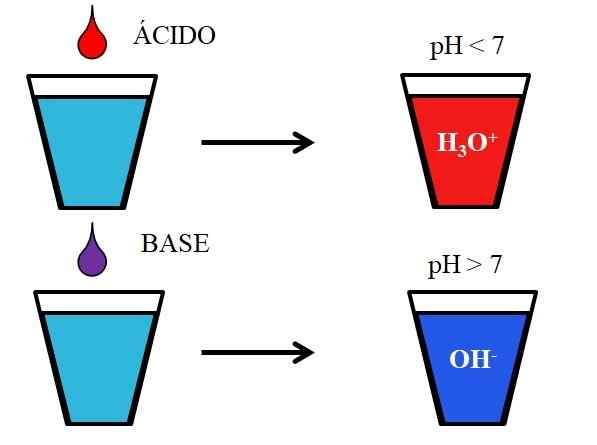 Comportement des acides et des bases lorsqu'il est dissous dans l'eau. Source: Gabriel Bolívar.
Comportement des acides et des bases lorsqu'il est dissous dans l'eau. Source: Gabriel Bolívar. L'image inférieure montre le comportement générique des acides et des bases lorsqu'ils sont ajoutés ou dissous dans un verre avec de l'eau. Les acides produisent des solutions avec des valeurs de pH inférieures à 7 en raison des ions hydronios, H3SOIT+; Alors que les bases produisent des solutions avec un pH supérieur à 7 en raison des ions hydroxyles (ou oxydril), OH-.
Si nous ajoutons de l'acide chlorhydrique, du HCl (Drop), au verre, il y aura des ions H3SOIT+ et cl- hydraté. D'un autre côté, si nous répétons l'expérience avec l'hydroxyde de sodium, NaOH (Droppt Drop), nous aurons des ions OH- et na+.
[TOC]
Définitions

Les caractéristiques, de plus en plus étudiées et comprises, des acides et des bases définissent plus d'une définition de ces composés chimiques. Parmi ces définitions, nous avons celle d'Arrhenius, celle de Bronsted-Lowry, et enfin celle de Lewis. Avant de citer les exemples, il est nécessaire d'avoir ce clair.
Arrhenius
Les acides et les bases, selon Arrhenius, sont ceux qui se dissolvent dans l'eau produisent des ions3SOIT+ ou oh-, respectivement. C'est-à-dire que l'image représente déjà cette définition. Cependant, en soi, il méprise des acides ou des bases trop faibles pour produire de tels ions. C'est là que la définition de Bronsted-Lowry entre.
Peut vous servir: acides: caractéristiques et exemplesBraquée
Les acides Bronsted-Lowry sont ceux qui peuvent donner des ions H+, Et les bases sont celles qui acceptent ces H+. Si un acide fait un don très facilement+, Cela signifie que c'est un acide fort. Il en va de même pour les bases, mais accepter H+.
Ainsi, nous avons des acides et des bases forts ou faibles, et leurs forces sont mesurées dans différents solvants; Surtout dans l'eau, dont les unités de pH connues sont établies (de 0 à 14).
Par conséquent, un acide fort donnera complètement son H+ à l'eau dans une réaction du type:
Ha + h2O => A- + H3SOIT+
Où- C'est la base conjuguée de HA. De là, c'est donc le h3SOIT+ présent dans le verre avec une solution acide.
Pendant ce temps, une base B faible ne sera pas protégé l'eau pour gagner son H respectif+:
B + h2Ou hb + oh-
Où Hb est l'acide conjugué de b. C'est le cas de l'ammoniac, NH3:
NH3 + H2Ou NH4+ + Oh-
Une base très forte peut directement donner des ions OH- Pas besoin de réagir avec l'eau; Comme avec le naoh.
Lewis
Enfin, les acides Lewis sont ceux qui gagnent ou acceptent les électrons, et les bases de Lewis sont celles qui donnent ou perdent des électrons.
Par exemple, la base Bronsted-Lowry NH3 C'est aussi une base de Lewis, car l'atome d'azote accepte un H+ En donnant cela, leur paire d'électrons libres (H3N: H+). C'est pourquoi les trois définitions ne sont pas en désaccord les unes avec les autres, mais elles s'entrelacent et aident à étudier l'acidité et la basicité dans un spectre plus large de composés chimiques.
Peut vous servir: nickel: historique, propriétés, structure, utilisations, risquesExemples d'acides
Après avoir clarifié les définitions, une série d'acides sera mentionnée ci-dessous avec leurs formules et noms respectifs:
-HF: acide fluorhydrique
-HBR: acide bromhydrique
-Salut: acide yodhydrique
-H2S: acide sulfhydrique
-H2SE: acide sélénhydrique
-H2TE: acide télélutrydrique
Ce sont des acides binaires, également appelés hydraceids, qui appartiennent à l'acide chlorhydrique susmentionné, HCl.
-HNO3: acide nitrique
-HNO2: Acide nitreux
-HNO: acide hyponitreux
-H2CO3: Acide carbonique
-H2CO2: Acide carbonoso, qui est en fait davantage connu sous le nom de l'acide formique, HCOOH, l'acide organique le plus simple de tous
-H3Pote4: acide phosphorique
-H3Pote3 ou h2[HPO3]: acide phosphoreux, avec une liaison H-P
-H3Pote2 ou h [h2Pote2]: acide hypophosphosphérique, avec deux liaisons H-P
-H2Swin4: acide sulfurique
-H2Swin3: Acide sulfureux
-H2S2SOIT7: acide disulfurique
-Hio4: acide périódique
-Hio3: Acide yodium
-Hio2: acide d'iodose
-Hio: Hypoyodoso Acid
-H2Cro4: acide chromique
-HMNO4: Acide manganique
-Ch3COOH: acide acétique (vinaigre)
-Ch3Swin3H: acide métanosulfonique
Tous ces acides, à l'exception des Formic et des deux derniers, sont connus sous le nom d'Oxácidos ou d'acides ternaires.
Autres:
-ALCL3: chlorure d'aluminium
-Fecl3: chlorure ferrique
-Petit ami3: Boro trifluoruro
-Cations métalliques dissoutes dans l'eau
-Carbocations
-H (chbonzeCLonze): Super acide carborano
- FSO3H: acide fluorosulfonique
- Hsbf6: Acide fluoroantimonique
- FSO3H · SBF5: Acide magique
Les quatre derniers exemples constituent les super-acides redoutables; composés capables de désintégrer presque tous les matériaux avec à peine le toucher. L'alcl3 C'est un exemple d'acide Lewis, car le centre de métal en aluminium est capable d'accepter les électrons en raison de sa carence électronique (il ne complète pas son octet de valence).
Peut vous servir: Hydroxyde de mercure: structure, propriétés, utilisations, risquesExemples de bases
Parmi les bases inorganiques, nous avons des hydroxydes métalliques, comme l'hydroxyde de sodium, et certaines hydurns moléculaires, comme l'ammoniac déjà cité. Voici d'autres exemples de bases:
-Koh: hydroxyde de potassium
-LioH: hydroxyde de lithium
-RBOH: Hydroxyde de Rubidio
-CSOH: hydroxyde de césium
-Froh: Hydroxyde franco
-Être (oh)2: hydroxyde de Beryl
-Mg (oh)2: l'hydroxyde de magnésium
-Ca (oh)2: hydroxyde de calcium
-SR (OH)2: Hydroxyde de strontium
-Ba (oh)2: hydroxyde de baryum
-Ra (oh)2: Hydroxyde de radio
-Foi (OH)2: hydroxyde ferreux
-Foi (OH)3: hydroxyde ferrique
-Al (oh)3: hydroxyde d'aluminium
-PB (OH)4: Hydroxyde de Plúmbic
-Zn (OH)2: hydroxyde de zinc
-CD (OH)2: hydroxyde de cadmium
-Cu (oh)2: Hydroxyde cuprique
-Ti (oh)4: Hydroxyde titanic
-PH3: phosphine
-Cendre3: Arsina
-Nanh2: Sodium Amiduro
- C5H5N: pyridine
-(Ch3) N: triméthylamine
- C6H5NH2: Phénylamine ou aniline
-Non: hydrure de sodium
-Kh: hydrure de potassium
-Carbanions
-Li3N: nitrure de lithium
-Alcoxydes
-[(Ch3)2Ch]2NLI: diisopropilamide de lithium
-Anion de diététinbenzène: C6H4C42- (la base la plus forte connue jusqu'à présent)
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Naomi Hennah. (10 octobre 2018). Comment enseigner les acides, les bases et les sels. Récupéré de: edu.RSC.org
- Helmestine, Anne Marie, Ph.D. (31 août 2019). Formules d'acides et de bases communs. Récupéré de: Thoughtco.com
- David Wood. (2019). Comparaison des acides et bases communs. Étude. Récupéré de: étudier.com
- Ross Pomeroy. (23 août 2013). Les acides les plus forts du monde: comme le feu et la glace. Récupéré de: realClearscience.com
- Wikipédia. (2019). Diéthynbenzène dianion. Récupéré de: dans.Wikipédia.org
- « Symboles et formules de diamètre, comment le retirer, circonférence
- Écophysiologie Quelles études et applications chez les animaux et légumes »

