Potassium Yodato (Kio3)
- 3131
- 892
- Prof Ines Gaillard
Qu'est-ce que l'iodate de potassium?
Potassium ou potassium Yodato Yodato est un composé d'iode inorganique, en particulier un sel, dont la formule chimique est le kio3. L'iode ou l'iode, élément du groupe halogène (f, cl, br, i, as), a dans ce sel un nombre d'oxydation de +5; C'est pourquoi c'est un agent oxydant fort. Le kio3 Il se dissocie en milieu aqueux pour créer les ions k+ et Io3-.
Il est synthétisé en réagissant l'hydroxyde de potassium avec de l'acide yodium: Hio3(aq) + koh (s) => kio3(aq) + h2Ou (l). De plus, il peut être synthétisé en réagissant à l'iode moléculaire avec de l'hydroxyde de potassium: 3i2(s) + 6koh (s) => kio3(aq) + 5ki (aq) + 3h2Ou (l).
Propriétés de Yodato au potassium
 Aspect yodato de potassium
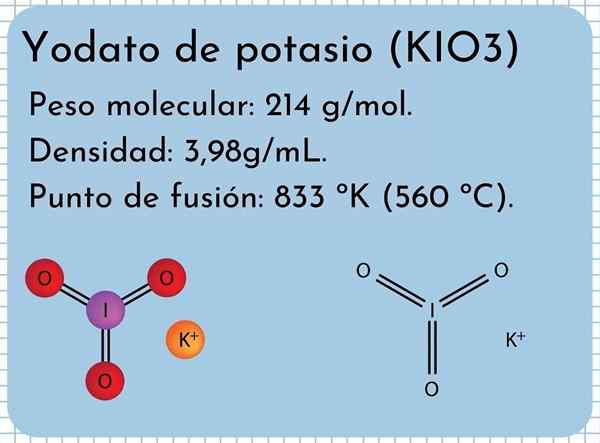
Aspect yodato de potassium C'est une odor sans odor, des cristaux fins et avec une structure cristalline monoclinique. Il a une densité de 3,98 g / ml, un poids moléculaire de 214 g / mol et présente des bandes d'absorption dans le spectre infrarouge (IR).
Il a un point de fusion: 833 ºK (560 ºC), composé de fortes interactions ioniques entre les ions k+ et Io3-. À des températures plus élevées, une réaction de décomposition thermique, libérant de l'oxygène moléculaire et de l'iodure de potassium:
2kio3(s) => 2ki (s) + 3o2(g)
Dans l'eau, il a des solubilités qui varient de 4,74 g / 100 ml à 0 ºC, jusqu'à 32,3 g / 100 ml à 100 ºC, générant des solutions aqueuses incolores. De plus, il est insoluble dans l'alcool et l'acide nitrique, mais il est soluble dans l'acide sulfurique dilué.
Son affinité pour l'eau n'est pas appréciable, ce qui explique pourquoi il n'est pas hygroscopique et n'existe pas sous forme de sels hydratés (Kio3· H2SOIT).
Agent d'oxydation
Potassium Yodato, comme indiqué par sa formule chimique, a trois atomes d'oxygène. Il s'agit d'un élément fortement électronégatif et, en raison de cette propriété, il laisse «découvert» une carence en nuage électronique qui entoure l'iode.
Peut vous servir: gaz inerteCette carence - ou contribution, selon le cas, peut être calculée comme le nombre d'oxydation de l'iode (± 1, +2, +3, +5, +7), étant +5 dans le cas de ce sel.
Qu'est ce que ça signifie? Qu'avant une espèce capable de donner leurs électrons, l'iode les acceptera sous leur forme ionique (IO3-) pour devenir l'iode moléculaire et avoir un nombre d'oxydation égal à 0.
Suite à cette explication, il peut être déterminé que l'iodate de potassium est un composé oxydant qui réagit intensément avec des agents réducteurs dans de nombreuses réactions redox; De tout cela, on est connu comme une horloge d'iode.
L'horloge d'iode se compose d'un processus redox de pas lents et rapides, dans lesquels les étapes rapides sont marquées par une solution Kio3 Dans l'acide sulfurique auquel l'amidon est ajouté. Ensuite, l'amidon, on a produit et ancré parmi sa structure l'espèce i3-- Il fera la solution bleu colorée au bleu foncé.
Io3- + 3 HSO3- → I- + 3 HSO4-
Io3- + 5 I- + 6 h+ → 3 I2 + 3 h2SOIT
Toi2 + HSO3- + H2O → 2 I- + HSO4- + 2 h+ (bleu foncé à cause de l'amidon)
Structure chimique
 Structure de Yodato au potassium
Structure de Yodato au potassium Dans l'image supérieure, la structure chimique de l'iodate de potassium est illustrée. L'anion io3- Il est représenté par le "trépied" des sphères rouges et violettes, tandis que les k ions+ Ils sont représentés par des sphères violettes.
Mais que signifient ces trépieds? Les formes géométriques correctes de ces anions sont en fait des pyramides trigonales, dans lesquelles l'oxygène constitue la base triangulaire, et le couple non partagé des points d'iode à l'étage, occupant l'espace et forçant à plier le lien I-O et les deux liens i = o.
Peut vous servir: acide tartriqueCette géométrie moléculaire correspond à une hybridation SP3 de l'atome central de l'iode; Cependant, une autre perspective suggère que l'un des atomes d'oxygène forme des liens vers les orbitales "D" d'iode, étant en fait une hybridation du type SP3d2 (L'iode peut avoir ses orbitales "d" élargissant sa couche de valence).
Les cristaux de ce sel peuvent subir des transitions de phase structurelle (autres arrangements autres que monocliniques) en raison des différentes conditions physiques qui les soumettent.
Utilisations et applications de l'iodate de potassium
Utilisation thérapeutique
Le yodato de potassium est généralement utilisé pour éviter l'accumulation de radioactivité dans la thyroïde sous la forme de 131I, lorsque cet isotope est utilisé pour déterminer l'iode par la thyroïde comme composant du fonctionnement de la glande thyroïde.
De même, le yodato au potassium est utilisé comme antiseptique topique (0,5%) dans les muqueuses.
Utilisation dans l'industrie
Il est ajouté à la nourriture des animaux reproducteurs comme un supplément d'iode. Par conséquent, le yodato au potassium est utilisé dans l'industrie pour améliorer la qualité des farines.
Utilisation analytique
En chimie analytique, grâce à sa stabilité, il est utilisé comme modèle principal dans la normalisation des modèles de thiosulfate de sodium (NA2S2SOIT3), dans le but de déterminer les concentrations d'iode dans les problèmes.
Cela signifie que les quantités d'iode peuvent être connues par des techniques volumétriques (degrés). Dans cette réaction, l'iodate de potassium s'oxyde rapidement aux ions iodure i-, Grâce à l'équation chimique suivante:
Peut vous servir: acétate de plomb: structure, propriétés, obtention, utilisationsIo3- + 5i- + 6h+ => 3i2 + 3h2SOIT
L'iode, je2, est intitulé avec la solution na2S2SOIT3 pour sa normalisation.
Utiliser dans la technologie laser
Des études ont démontré et corroboré les propriétés optiques piézoélectriques, pyroélectriques, électromédélectriques et non linéaires et non linéaires des kio cristaux3. Il en résulte de grands potentiels dans le champ électronique et dans la technologie des lasers pour les matériaux fabriqués avec ce composé.
Risques pour la santé du yodate de potassium
À fortes doses, il peut produire des irritations dans la muqueuse buccale, la peau, les yeux et les voies respiratoires.
Les expériences de la toxicité de l'iodate de potassium chez les animaux nous ont permis d'observer que chez les chiens à des doses rapides de 0,2 à 0,25 g / kg de poids corporel, fournies par voie orale, le composé provoque des vomissements.
Si ces vomissements sont évités, il produit chez les animaux une aggravation de leur situation, car une anorexie et avant le décès est induite. Ses autopsies ont permis d'observer les lésions hépatiques nécrotiques, les reins et la muqueuse intestinale.
En raison de sa puissance oxydante, il représente un risque de feu lorsqu'il entre en contact avec des matériaux inflammables.
Les références
- Jour, r., & Underwood, un. Chimie analytique quantitative (Fifth Ed.). Pearson Prentice Hall, P-364.
- Livre chimique. (2017). Iodate de potassium. Récupéré le 25 mars 2018 de ChemicalBook: ChemicalBook.com
- Se publier. (2018). Iodate de potassium. Récupéré le 25 mars 2018 de PubChem: PubChem.NCBI.NLM.NIH.Gouvernement
- Miserrer. (2018). Yodato au potassium. Récupéré le 25 mars 2018 de Merck:
- Merckmillipore.com
- M m Abdel Kader et al. (2013). Mécanisme de transport de charge et transitions de phase à basse température dans Kio3. J. Chèque.:. Être. 423 012036

