Oxydes non métalliques

- 4527
- 791
- Paul Dumas
 Le dioxyde de carbone est un gaz à effet de serre et est également un oxyde non métallique
Le dioxyde de carbone est un gaz à effet de serre et est également un oxyde non métallique Quels sont les oxydes non métalliques?
Les oxydes non métalliques Ce sont des composés binaires formés entre un non-métal avec un état d'oxydation positif et l'oxygène avec l'état d'oxydation -2. Également appelées anhydrides et oxydes acides, ces composés ont tendance à former des solutions acides en les dissolvant dans l'eau, et ont également tendance à réagir avec des oxydes de base pour former des sels oxisaux.
Les oxydes non métalliques sont de nature très courante. En fait, ils sont partout. L'eau, le liquide vital qui couvre les deux tiers de la surface de la Terre, est un oxyde non métallique. Il en va de même pour le dioxyde de carbone que nous expirons pendant notre respiration et les oxydes de soufre qui contaminent l'air et qui provoquent des pluies acides.
Formé par des non-métaux et de l'oxygène (qui est également un non-métal), les liens qui unissent leurs atomes sont des liaisons covalentes, dans la plupart des cas polaires. Pour cette raison, la grande majorité des oxydes non métalliques ou anhydrides ont des points d'ébullition considérablement faibles, et beaucoup d'entre eux sont des gaz à température ambiante.
Propriétés des oxydes non métalliques
- Ils n'ont pas de lustre ni de brillance métallique.
- Ils peuvent avoir des couleurs différentes.
- Leurs atomes sont unis au moyen d'obligations covalentes au lieu de liens ioniques.
- Ils sont formés par l'oxygène et un non-métal.
- Par rapport aux oxydes métalliques, ils ont généralement de faibles points de fusion et d'ébullition, bien que très divers.
- La plupart sont des gaz, mais peuvent également être trouvés à l'état solide (comme n2SOIT3) ou liquide à température ambiante.
- Les oxydes non métalliques solides sont généralement cassants et peuvent avoir une dureté différente.
- Ce sont de mauvais conducteurs de chaleur et d'électricité.
- Lors de leur dissolution dans l'eau, ils réagissent pour former des acides oxacides.
- Certains de ses acides oxacides sont de forts acides qui ont tendance à former des anions ou des oxyanions en solution aqueuse.
- Ils réagissent avec des oxydes de base pour former des sels oxisaux.
Types d'oxydes non métalliques
Il n'y a pas de classification formelle ou universellement acceptée des oxydes non métalliques. Cependant, ceux-ci peuvent être regroupés en fonction de leurs propriétés acide-base.
Bien que les oxydes non métalliques soient également appelés oxydes acides, tous ne réagissent pas toujours comme des acides contre d'autres composés. Compte tenu de cela, trois types différents d'oxydes non métalliques peuvent être identifiés en fonction de leurs propriétés acides / base:
Oxydes d'acide non métallique
Ils sont les plus courants. La grande majorité des composés entre l'oxygène et un autre non-métal, quel que soit leur statut d'oxydation, produisent des acides minéraux lors de leur dissolution dans l'eau, donnant naissance à des solutions acides.
- Quelques exemples d'oxydes acides sont l'anhydride nitrique (n2SOIT5) et l'anhydride sulfurique (donc3).
Oxydes non métalliques neutres
Certains oxydes non métalliques ne réagissent pas du tout avec l'eau lors de la dissolution. Dans ces cas, la solution résultante est neutre (elle n'est ni acide ni basique).
- Quelques exemples d'oxydes neutres sont le monoxyde de carbone (CO), l'oxyde nitreux (N₂O) et le dioxyde de chlore (CLO2).
Oxydes amphotoureux non métalliques
Le terme Anfótero Il se réfère à la capacité d'un composé chimique à se comporter comme un acide ou comme une base, selon qui réagit. C'est-à-dire que ce sont des composés qui sont à la fois des acides et des bases en même temps.
- Parmi les oxydes amphotiques non métalliques, le plus courant est l'eau (h2SOIT). L'eau est amphotente, car il est capable de donner un proton à une base (agissant comme un acide), mais il est également capable de recevoir un proton d'acide (agissant comme base).
Exemples d'oxydes non métalliques
Les oxydes non métalliques les plus courants de chaque non-métal sont présentés ci-dessous, ainsi que sa formule moléculaire, son nom selon la nomenclature systématique de l'IUPAC, selon la nomenclature des stocks et selon la nomenclature traditionnelle:
Oxydes de carbone
Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
CO | Monoxyde de carbone | Oxyde de carbone (II) | Anhydride en carbone |
CO2 | Dioxyde de carbone | Oxyde de carbone (IV) | Anhydride carbonique |
Oxydes d'azote
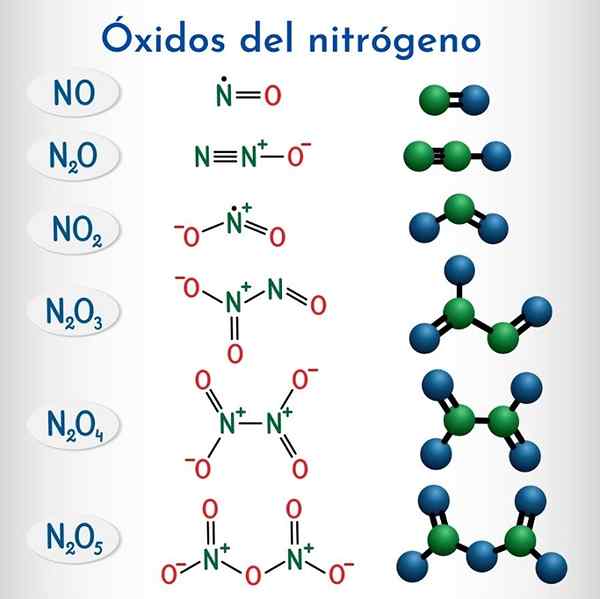 Formules et structures des 6 oxydes d'azote non métalliques
Formules et structures des 6 oxydes d'azote non métalliques Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
N2o | Monoxyde de dinitrogen | Oxyde d'azote (I) | Le protoxyde d'azote (Anhydride hiponitroso) |
NON | Monoxyde d'azote | Oxyde d'azote (II) | L'oxyde nitrique |
N2O3 | Trioxyde de dinitrogen | Oxyde d'azote (III) | Anhydride nitreux |
N2o4 | Tétraxide à dinitrogen | Oxyde d'azote (IV) | Tétraxide à azote |
No2 | Dioxyde d'azote | Oxyde d'azote (IV) | Dioxyde d'azote |
N2o5 | Pentaoxyde de dinitrogen | Oxyde d'azote (V) | Anhydride nitrique |
Oxydes de phosphore
Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
P2O3 | Trioxyde de diphosphack | Oxyde de phosphore (III) | Anhydrure de phosphore |
P2O5 | Diphosphack pentaoxyde | Oxyde de phosphore (V) | Anhydride phosphorique |
P2O4 | Diphosphack tétraxide | Oxyde de phosphore (iii, v) | --- |
Oxydes d'arsenic
Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
As2O3 | Trioxyde de diarré | Oxyde d'arsenic (III) | Anhydride arsenioso |
As2O5 | Pentaoxyde de diarré | Oxyde d'arsenic (V) | Anhydride d'arsenic |
Oxydes d'antimoine
Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
SB2O3 | Trioxyde de diantitie | Oxyde d'antimoine (III) | Anhydride antimonieux |
SB2O5 | Diantimony Pentaoxyde | Oxyde d'antimoine (V) | Anhydride antiimonique |
Oxydes de soufre
Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
Swin | Monoxyde de soufre | Oxyde de soufre (II) | Anhydride hyposulaire |
SO2 | Dioxyde de soufre | Oxyde de soufre (IV) | Anhydrure de soufre |
SỐ 3 | Trioxyde de soufre | Oxyde de soufre (VI) | Anhydride sulfurique |
Oxydes de sélénium
Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
Référencement | Monoxyde de sélénium | Oxyde de sélénium (II) | Anhydride hyposlorése |
SEO2 | Dioxyde de sélénium | Oxyde de sélénium (IV) | Anhydride sélénaire |
SEO3 | Trioxyde de sélénium | Oxyde de sélénium (VI) | Anhydride sélénique |
Oxydes de télélurio
Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
Teo | Monoxyde de télélurio | Oxyde de télélurio (II) | Anhydride hypelous |
Teo2 | Dioxyde de télélurio | Oxyde de télélurio (IV) | Anhydride télélumeux |
Teo3 | Trioxyde de télésurre | Oxyde de télélurio (VI) | Anhydride tellurique |
Oxydes de chlore
Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
CL2O | Chlore monoxyde | Oxyde de chlore (i) | Anhydride hypoclé |
Cl2o3 | Trioxyde de chlore | Oxyde de chlore (III) | Chloro anhydride |
Cl2o5 | Pentaoxyde de chlore | Oxyde de chlore (V) | Anhydride chlorique |
Cl2O7 | Heptoxyde de chlore | Oxyde de chlore (VII) | Anhydride perchlorique |
Oxydes de brome
Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
BR2O | Monoxyde de brome | Oxyde de brome (i) | Anhydride hipobro |
BR2O3 | Trioxyde de brome | Oxyde de brome (III) | Anhydride |
BR2O5 | Pentaoxyde de brome | Oxyde de brome (V) | Anhydride brommique |
BR2O7 | Heptaoxyde de brome | Oxyde de brome (VII) | Anhydride perbromique |
Oxydes d'iode
Formule | Nom systématique IUPAC | Nomenclature des stocks | Nom traditionnel |
I2o | Monoxyde d'iode | Oxyde d'iode (i) | Hypoyodoso anhydride |
I2O3 | Trioxyde d'iode | Oxyde d'iode (III) | Yodoso anhydride |
I2O5 | Pentaoxyde d'iode | Oxyde d'iode (V) | Anhydride yodium |
I2O7 | Heptoxyde d'iode | Oxyde d'iode (VII) | Anhydride périódicoque |

