Structure d'oxyde de magnésium, propriétés, nomenclature, utilisations

- 2206
- 484
- Noa Da silva
Il l'oxyde de magnésium C'est un solide inorganique blanc cristallin également connu sous le nom de magnésie. Sa formule chimique est MGO et est formée par oxydation du magnésium métal par oxygène.
Il se trouve souvent comme un minéral naturel appelé périclase. Cependant, la périclase n'est pas une source importante du MGO. Dans la nature, il se trouve couramment comme des groupes de cristaux dans le marbre.
 Oxyde de magnésium en poudre. Adam Rędzikowski [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Source: Wikipedia CommunStation se trouve également dans le Magnceta Mineral (qui est principalement du carbonate de magnésium avec des carbonates de fer); dans le calcaire et la dolomite (minéral formé par le magnésium et les carbonates de calcium); dans les éjections volcaniques et dans les roches serpentines.
Oxyde de magnésium en poudre. Adam Rędzikowski [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Source: Wikipedia CommunStation se trouve également dans le Magnceta Mineral (qui est principalement du carbonate de magnésium avec des carbonates de fer); dans le calcaire et la dolomite (minéral formé par le magnésium et les carbonates de calcium); dans les éjections volcaniques et dans les roches serpentines.
Ne formez pas de roches ou de dépôts de cristal car en contact avec la vapeur d'eau de l'atmosphère, il devient l'hydroxyde de magnésium (mg (OH)2).
Au niveau industriel, il peut être obtenu de plusieurs manières: calcinant le carbonate de magnésium (magnésite), calcinant l'hydroxyde de magnésium, du calcaire dolomitique, par l'eau de mer et la pyrolyse du chlorure de magnésium, entre autres méthodes.
La production de magnésie à partir de Magncesita a commencé il y a un peu plus de 100 ans en Autriche. Depuis lors, la magnésie a plusieurs applications techniques en raison de son point de fusion élevé, de sa résistance chimique, de sa conductivité thermique élevée, de sa faible conductivité électrique et de son activité biologique.
[TOC]
Structure
La structure cristalline du MGO est cubique, axée sur les faces, similaires au réseau cristallin de chlorure de sodium (NaCl).
La magnésie forme des cristaux cubes hexaoctahébédiques, qui peuvent être incolores, verts ou marron.
Le minéral périclasse est un petit octaèdre, étant moins généralement un cube-octaedro ou un dodécaèdre.
Propriétés
Autres noms
- Magnésie.
- Périclase.
- Oxomagnésium.
État physique
Il est solide, cristallin et blanc. Bien que la présence d'impuretés de fer confère une coloration verdâtre ou brune en fonction du degré d'oxydation du fer.
Dureté mohs
5.5-6.
Poids moléculaire
40 304 g / mol.
Point de fusion
2827 ºC.
Densité
3 581 g / cm3
Solubilité
Pratiquement insoluble dans l'eau:
0,00062 g pour 100 ml à 20 ° C.
0,0086 g pour 100 ml à 30 ° C.
Insoluble dans l'éthanol.
pH
En solution aqueuse saturée: 10,3.
Peut vous servir: oxyde de calcium (CAO)Propriétés optiques
Transparent. Couleur: incolore, blanc grisâtre, jaune brunâtre, incolore en lumière transmise.
Indice de réfraction
1 7355 à 589 nm.
1 7283 à 750 nm.
Autres propriétés
- Il a une conductivité thermique élevée et une résistivité électrique élevée.
- Il est hygroscopique, c'est-à-dire absorber facilement l'eau de l'atmosphère. En milieu aqueux, il est combiné avec de l'eau pour former l'hydroxyde de magnésium.
- Il est stable dans l'atmosphère oxydante à 2300 ºC et jusqu'à 1700 ºC dans une atmosphère réductrice.
- Il est compatible avec la plupart des composés chimiques, sauf avec de forts acides et oxydants forts, entre autres.
- Après l'allumage à des températures élevées, l'oxyde de magnésium est relativement inerte.
- Ce n'est pas toxique. Cependant, des précautions doivent être prises lors de la manipulation sous forme de poussière lorsqu'il a une petite taille de particules.
- Leurs cristaux ont une puissance réfléchissante élevée dans le spectre visible et dans le quasi ultraviolet.
Nomenclature
Il y a plusieurs degrés de MGO qui sont fournis dans le commerce:
Magnésie caustique
Il s'agit d'une forme hautement réactive d'oxyde de magnésium produit par calcination ou brûlure de magnésite cru (MGCO3) ou l'hydroxyde de magnésium (mg (OH)2) à des températures relativement basses, mais au-dessus de la température de décomposition de ces matériaux, entre 700 et 1000 ° C.
Il est également appelé magnésie caustique calcinée, oxyde de magnésium calciné, oxyde de magnésium réactif, magnésie légèrement brûlée (traduction anglaise Brûlé), Entre autres noms.
La magnésie caustique peut être brûlée à une température plus élevée pour donner une magnésie de frittage.
La magnésie fortement brûlée
Il se produit lorsque la magnésite est calculée à des températures de 1000 à 1500 ºC. Sa réactivité a été réduite par rapport à la magnésie caustique.
Magnésie rEfractario
Lorsque la magnésite est calculée à des températures entre 1500 et 2000 ºC, la «mort brûlée» (traduction de l'anglais Brûlé), également appelé magnésie réfractaire ou magnésie fondu.
La magnésia folklorique est également obtenue par fusion de magnésie caustique dans un arc électrique. En raison de ces traitements, leur réactivité a été presque complètement éliminée.
Ce type de magnésie est généralement modélisé par la pression et la température, sans atteindre la température de fusion. Cela vient de produire une grande dureté, appelant la magnésie de frittage. Il est essentiellement stable contre l'humidité et le dioxyde de carbone atmosphérique.
Peut vous servir: processus adiabatique: types, exemples, exercices résolusApplications
MgO est utilisé dans la production de magnésium métallique.
Utilisations de la magnésie caustique
En raison de sa forte réactivité, ses applications industrielles sont très variées.
Il est utilisé comme matière première pour faire du ciment.Il est utilisé dans l'industrie de la construction, par exemple, comme liant. Dans ce cas, il est mélangé à des solutions concentrées de sels de magnésium et à une petite quantité de phosphate de sodium.
Ainsi un matériau extrêmement dur est obtenu. Bien que ce ne soit pas un vrai ciment, car il n'est pas stable dans l'eau, il peut être utilisé comme mât protecteur ou revêtement.
La magnésie caustique est également utilisée dans des panneaux de construction légers pour l'isolation thermique et acoustique. Ils sont fabriqués en ajoutant du sulfate de magnésium sous forme de liant et de laine minérale. Ce sont des feuilles très non inflammables.
 Feuilles de mgo de construction. Eccentrik13 [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Source: Wikipedia Communsents Autres utilisations de la magnésie caustique est l'élimination des métaux lourds et le silicate des eaux usées. Vous pouvez également éliminer l'ammoniac ou les phosphates.
Feuilles de mgo de construction. Eccentrik13 [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Source: Wikipedia Communsents Autres utilisations de la magnésie caustique est l'élimination des métaux lourds et le silicate des eaux usées. Vous pouvez également éliminer l'ammoniac ou les phosphates.
C'est une base faible, donc il sert de neutralisant acide et est utilisé dans le lavage des gaz de la cheminée, comme additif pour les lubrifiants et les carburants.
Il sert de remplissage de l'industrie du plastique et du caoutchouc, car il permet de régler la viscosité et la rigidité de ces matériaux.
Il est utilisé dans l'industrie du papier et de la cellulose car il participe à la digestion des bisulfites. Aussi absorbant l'humidité dans les bibliothèques ou pour la préparation des cosmétiques. De plus, dans l'industrie pharmaceutique, il est très apprécié comme antiacide, soulagement de l'indigestion et du laxatif doux.
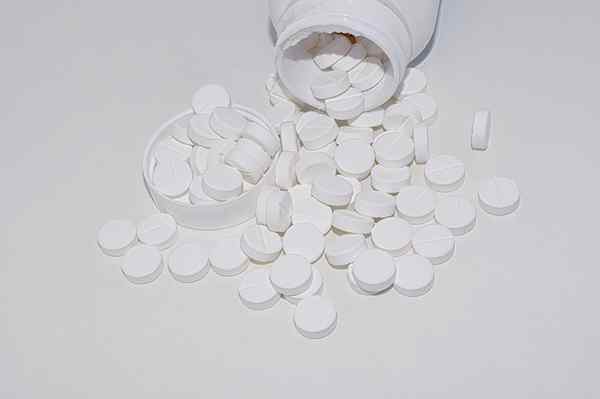 Comprimés de mgo. Source: Pixabay
Comprimés de mgo. Source: Pixabay Utilisations de la magnésie fortement brûlée
En raison de son intervalle de réactivité étroit, il est utilisé dans les applications où une dégradation lente est requise. Par exemple, dans les suppléments d'aliments pour animaux. En effet.
D'un autre côté, il est connu que le magnésium (Mg) est un élément constituant de la chlorophylle. Par conséquent, il est considéré comme un nutriment essentiel des plantes et utilisé comme engrais. La façon d'ajouter du magnésium aux plantes est comme la magnésie.
Peut vous servir: oxyde de ferCe type de MGO peut être utilisé dans une variété d'applications: céramique, traitement des eaux usées (telles que l'adsorbant de cations en élimination des métaux), un bronzage de cuir et des matières premières pour la magnésie en fusion.
Utilisations de la magnésie sinsérisée et de la magnésie fondatrice
Le MGO a le point de fusion le plus élevé parmi les oxydes à coût modéré et est donc une matière première pour les briques réfractaires et autres céramiques réfractaires. C'est le seul matériau, après l'oxyde de zroch (zro2), ce qui peut supporter un réchauffement prolongé au-dessus de 2000 ºC.
Ce degré réfractaire de MGO est utilisé dans l'industrie sidérurgique pour fabriquer des enveloppements de protection et des revêtements remplaçables d'équipements qui manipulent de l'acier fondu, comme une puissance très élevée.
 Fours à haute puissance dans l'industrie sidérurgique. Jean-Pol Grandmont [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Source: Commonsdebido Wikipedia à son degré de réactivité presque nul, les matériaux de construction réfractaires basés sur la magnésie de frittage sont également résistants aux scories et aux gaz basiques ou neutres.
Fours à haute puissance dans l'industrie sidérurgique. Jean-Pol Grandmont [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Source: Commonsdebido Wikipedia à son degré de réactivité presque nul, les matériaux de construction réfractaires basés sur la magnésie de frittage sont également résistants aux scories et aux gaz basiques ou neutres.
Les blocs de magnésie sincorisés ont une capacité de stockage de chaleur élevée et une conductivité thermique élevée (elles conduisent très bien la chaleur).
La chaleur générée par un élément chauffant est transférée dans le bloc de magnésie et augmente sa température. Pour cette raison, ils sont utilisés dans des dispositifs de stockage chauds.
Il est utilisé comme un matériau isolant dans l'industrie du chauffage électrique lié aux artefacts nationaux. Par exemple, pour les éléments tubulaires du chauffage des fournais de cuisine, des machines à laver, des machines à café, des assiettes électriques ou des radiateurs, entre autres.
Autres utilisations du MGO
La puissance réfléchissante élevée des cristaux MgO dans le spectre visible et UV a conduit à son utilisation comme réflecteur dans les instruments optiques et comme cristaux uniques dans les fenêtres et objectifs optiques. Il est également utilisé comme norme blanche.
Les références
- Kirk-othmer (1994). Encyclopédie de la technologie chimique. Volume 15. Quatrième édition. John Wiley & Sons.
- Encyclopédie de la chimie industrielle d'Ullmann. Volume A15. CINQUIÈME ÉDITION.
- Danse, j.C.; Emeléus, h.J.; et Sir Ronald Nyholm. (1973). Chimie inorganique complète. Éditorial du conseil d'administration. Presse à pergamon.
- S. Bibliothèque nationale de médecine. (2019). L'oxyde de magnésium. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- American Elements (2019). Magnésie calcinée caustique. Récupéré des Américains.com.
- Ropp, r.C. (2013). Groupe 16 (O, S, SE, TE) Composés de la Terre alcaline. L'oxyde de magnésium. Dans l'encyclopédie des composés terrestres alcalins. Récupéré de ScienceDirect.com.
- « Caractéristiques, fonctions et types d'épithélium plat simples
- Xiuhtecuhtli attributs, mythologie et cultes »

