Oxyde de lithium
- 4250
- 515
- Justine Charpentier
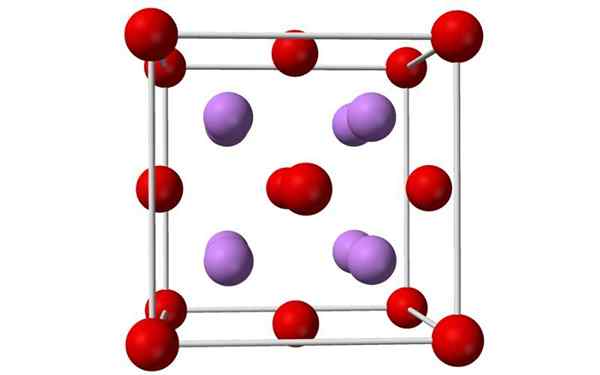
 Modèles de sphères et de barres d'une cellule d'oxyde de lithium unitaire. Source: Benjah-Bmm27, Wikimedia Commons
Modèles de sphères et de barres d'une cellule d'oxyde de lithium unitaire. Source: Benjah-Bmm27, Wikimedia Commons Qu'est-ce que l'oxyde de lithium?
Il Oxyde de lithium C'est un composé chimique inorganique de la formule Li2Ou qui se forme avec de petites quantités de peroxyde de lithium lorsque le lithium métal est brûlé dans l'air et se combine avec de l'oxygène.
Jusqu'aux années 90, le marché des métaux et du lithium était dominé par la production américaine à partir de dépôts minéraux, mais au début du 21e siècle, la majeure partie de la production était dérivée d'autres sources: l'Australie, le Chili et le Portugal étaient les fournisseurs les plus importants du monde. La Bolivie a la moitié des dépôts de lithium dans le monde, mais ce n'est pas un grand producteur.
La forme commerciale la plus importante est le carbonate de lithium, Li2CO3, produit à partir de minéraux ou de salmuelas par plusieurs processus différents.
Lorsque le lithium brûle dans l'air, le produit principal est l'oxyde de lithium blanc, Li2SOIT. De plus, un peu de peroxyde de lithium se produit, Li2SOIT2, Aussi blanc.
Cela peut également se faire par la décomposition thermique de l'hydroxyde de lithium, du lioh ou du peroxyde de lithium, Li2SOIT2.
4li (s) + o2(g) → 2li2Toi)
2lioh (s) + chaleur → li2Ou (s) + h₂o (g)
2li2SOIT2(s) + chaleur → 2li2Ou (s) + ou2(g)
Proprietes physiques et chimiques
- L'oxyde de lithium est un solide blanc connu sous le nom de Lithia, qui manque d'arôme et a une saveur salée.
- L'oxyde de lithium est des cristaux à géométrie antiflorite, similaire au chlorure de sodium (centré cube sur les faces).
- Son poids moléculaire est de 29,88 g / mol, sa densité est de 2 013 g / ml et les points de fusion et d'ébullition sont respectivement de 1438 ° C et 2066 ° C.
Il peut vous servir: péride- Le composé est très soluble dans l'eau, l'alcool, l'éther, la pyridine et le nitrobenzène.
- L'oxyde de lithium réagit facilement avec la vapeur d'eau pour former l'hydroxyde et le dioxyde de carbone pour former du carbonate; Par conséquent, il doit être stocké et géré dans une atmosphère propre et sèche.
- Les composés d'oxyde ne conduisent pas l'électricité. Cependant, certains oxydes structurés de Perovskita sont un conducteur électronique qui trouvent l'application dans la cathode à pile à combustible solide et les systèmes de génération d'oxygène.
- Ce sont des composés qui contiennent au moins un anion d'oxygène et un cation métallique.
Des risques
L'oxyde de lithium est un composé stable incompatible avec de forts acides, de l'eau et du dioxyde de carbone. Pour autant que nous le sachions, les propriétés chimiques, physiques et toxicologiques de l'oxyde de lithium n'ont pas été étudiées et rapportées en profondeur.
La toxicité des composés lithium est fonction de leur solubilité dans l'eau. L'ion lithium a une toxicité dans le système nerveux central. Le composé est hautement corrosif, irritant s'il entre en contact avec les yeux et la peau, lorsqu'il est inhalé ou ingéré.
En cas de contact visuel, vous devez vérifier si les lentilles de contact sont utilisées et les retirer immédiatement. Ils doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. L'eau froide peut être utilisée, et non une pommade oculaire.
Si le produit chimique entre en contact avec les vêtements, conservez-le le plus rapidement possible, en protégeant ses propres mains et son corps. Placer la victime sous une douche de sécurité.
Si le produit chimique s'accumule dans la peau exposée de la victime, comme les mains, la peau contaminée par de l'eau courante et du savon non abrasif est doucement lavée et soigneusement. L'eau froide peut être utilisée. Si l'irritation persiste, consulter un médecin. Laver les vêtements contaminés avant de l'utiliser à nouveau.
Peut vous servir: Scale de Rankine: ce qui est, les conversions, les exemplesEn cas d'inhalation, la victime devrait être autorisée à se tenir dans une zone bien ventilée. Si l'inhalation est grave, la victime doit être évacuée dans une zone sûre dès que possible.
Desserrer les vêtements serrés, comme des cou de chemise, des ceintures ou une cravate. Si la victime est difficile à respirer, l'oxygène doit être administré. Si la victime ne respire pas, une réanimation buccale est faite.
Compte tenu toujours de prendre en compte que cela peut être dangereux pour la personne qui fournit une aide à la réanimation bouche à bouche lorsque le matériau inhalé est toxique, infectieux ou corrosif. Dans tous les cas, des soins médicaux immédiats doivent être recherchés.
Applications
- L'oxyde de lithium est utilisé comme fondateur dans les émaux en céramique et crée du bleu avec du cuivre et des roses avec du cobalt. Réagit avec l'eau et la vapeur, formant un hydroxyde de lithium et doit être isolé d'eux.
- Oxyde de lithium (li2O), avec son haut potentiel tritio, il est un candidat attrayant pour le matériau de culture solide d'une usine d'énergie de fusion DT, en raison de sa haute densité d'atomes de lithium (par rapport à d'autres céramiques lithiums lithium ou métalliques) et sa conductivité thermique relativement élevée.
Li2O Il sera exposé à des températures élevées sous irradiation à neutrons pendant le fonctionnement des couvertures de fusion. Dans ces circonstances, un grand nombre de défauts d'irradiation seront produits en li2Ou, comme un gonflement induit par l'hélium, une expansion thermique relativement élevée, une croissance des grains, une formation Lyh (T) et des précipitations à basse température et le transport de la masse lioh (t) à des températures élevées.
De plus, le Li2Ou sera soumis à des tensions qui découlent des différences d'expansion thermique entre Li2O et matériaux structurels. Ces caractéristiques de Li2Ou entraîner des problèmes d'ingénierie difficiles à la fois dans la fabrication et dans la conception manta.
Peut vous servir: Strontium Hydrure (SRH2)- Une nouvelle utilisation possible est comme un remplacement pour l'oxyde de cobalt et de lithium, comme la cathode dans les batteries au lithium-ion utilisées pour augmenter les appareils de téléphone mobile électroniques sur les ordinateurs portables, ainsi que des voitures avec des batteries.
Les références
- Éléments américains. Oxyde de lithium. Récupéré des Américains américains.com.
- Oxyde de lithium. Récupéré des Espimetals Espimetals.com.
- Oxyde de lithium (li2o). Ferp a récupéré.UCSD.Edu ferp.UCSD.Édu.

