Oxyde de bore (B2O3) Qu'est-ce que la structure, les propriétés, les utilisations
- 1287
- 107
- Louna Baron
Il oxyde de bore L'anhydride borique est un composé inorganique dont la formule chimique est b2SOIT3. Étant des éléments de bore et d'oxygène du bloc P du tableau périodique, et encore plus de têtes de leurs groupes respectifs, la différence d'électronégativité entre eux n'est pas très élevée; Par conséquent, il est prévu que le b2SOIT3 être de nature covalente.
Le b2SOIT3 Il est préparé en dissolvant le borax dans l'acide sulfurique concentré à l'intérieur d'un four de fusion et à une température de 750 ° C; Déshydratant thermique acide borique, b (OH)3, à une température d'environ 300 ° C; ou il peut également être formé comme un produit de la réaction de diborano (b2H6) Avec de l'oxygène.
L'oxyde de boro peut avoir une apparence semi-transparente ou cristalline; Ce dernier par broyage peut être obtenu sous forme de poussière.
Bien qu'il ne semble pas à la première vue, le B est considéré2SOIT3 comme l'un des oxydes inorganiques les plus complexes; Non seulement d'un point de vue structurel, mais aussi en raison des propriétés variables que le verre et la céramique acquièrent à laquelle ils sont ajoutés à leur matrice.
Structure d'oxyde de boro
Unity Bo3
Le b2SOIT3 C'est un solide covalent, donc en théorie ils n'existent pas dans sa structure ion b3+ ni2-, Mais les liens B-O. Le boron, selon la théorie des liens de Valence (TEV), ne peut former que trois liens covalents; Dans ce cas, trois liens B-O. En conséquence, la géométrie attendue doit être trigonale, bo3.
La molécule BO3 Ce sont des électrons pauvres, en particulier les atomes d'oxygène; Cependant, plusieurs d'entre eux peuvent interagir les uns avec les autres pour assurer ladite carence. Ainsi, les triangles bo3 Ils sont rejoints en partageant un pont d'oxygène et sont distribués dans l'espace en tant que réseaux de lignes triangulaires avec leurs avions orientés de différentes manières.
Peut vous servir: solution insaturéeStructure cristalline
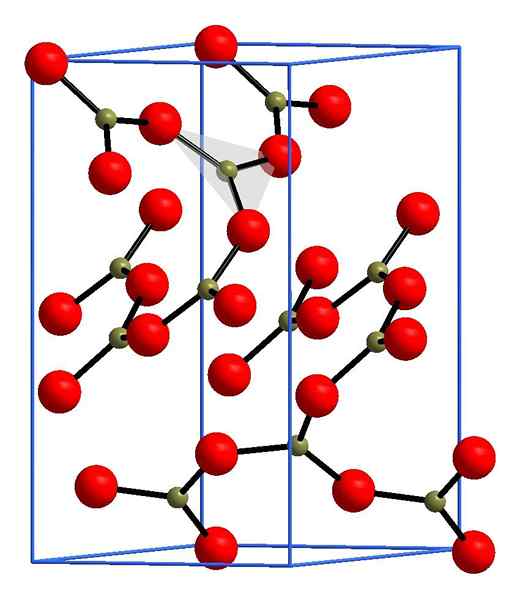
 Structure d'oxyde de boro. ANDIF1, Wikimedia Commons.
Structure d'oxyde de boro. ANDIF1, Wikimedia Commons. Dans l'image supérieure, un exemple de ces rangées avec des unités triangulaires bo3. S'il est observé attentivement, tous les visages des plans pointent vers le lecteur, mais de l'autre côté. Les orientations de ces visages peuvent être responsables de la définition de B2SOIT3 à une certaine température et pression.
Lorsque ces réseaux ont un motif structurel à long terme, c'est un solide cristallin, qui peut être construit à partir de sa cellule unitaire. C'est là qu'il est dit que le b2SOIT3 Il a deux polymorphes cristallins: α et β.
Le α-b2SOIT3 Il est produit en pression ambiante (1 atm), et on dit qu'il est cinétiquement instable; En fait, c'est l'une des raisons pour lesquelles l'oxyde de bore est probablement un composé de cristallisation difficile.
L'autre polymorphe, β-b2SOIT3, Des pressions élevées sont obtenues dans la gamme GPA; Par conséquent, sa densité doit être supérieure à celle de α-b2SOIT3.
Structure vitreuse
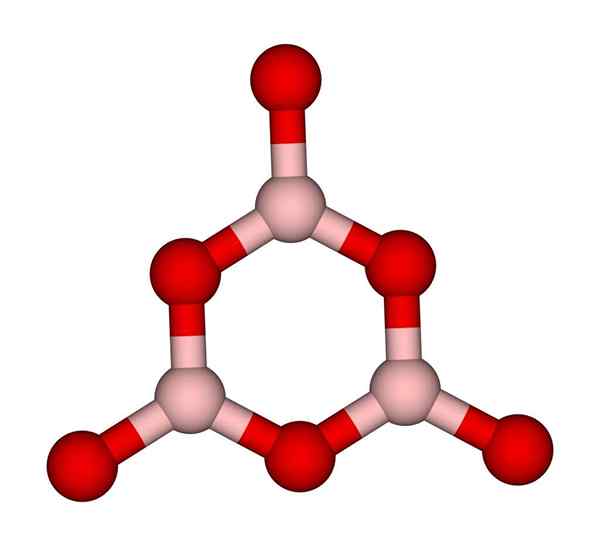 Bague de boroxol. Ccoil (talk). Wikimedia Commons.
Bague de boroxol. Ccoil (talk). Wikimedia Commons. Réseaux bo3 ont naturellement tendance à adopter des structures amorphes; Ce sont, qui manquent de modèle qui décrit les molécules ou les ions dans le solide. En synthétisant le b2SOIT3 Sa forme prédominante est amorphe et non la cristalline; En mots corrects: c'est un solide plus vitreux que cristallin.
On dit alors que le b2SOIT3 C'est vitreux ou amorphe lorsque vos garçons de Bo3 Ils sont désordonnés. Non seulement cela, mais aussi changer la façon dont ils se joignent. Au lieu de commander dans une géométrie trigonale, un anneau de boroxol (image supérieure) finit par créer les chercheurs (image supérieure).
Peut vous servir: 20 exemples d'énergie chimiqueNotez la différence évidente entre les unités triangulaires et hexagonales. Caractéristique triangulaire b2SOIT3 cristallin et hexagonal à b2SOIT3 vitreux. Une autre façon de se référer à cette phase amorphe est le verre de bore, ou au moyen d'une formule: G-B2SOIT3 (Le «G» vient du mot vitreux, en anglais).
Ainsi, les réseaux G-B2SOIT3 Ils sont composés d'anneaux de boroxol et non d'unités BO3. Cependant, le G-B2SOIT3 peut cristalliser en α-b2SOIT3, qui impliquerait une interconversion des anneaux aux triangles, et définirait également le degré de cristallisation atteint.
Propriétés
Apparence physique
C'est un solide incolore et vitreux. Dans sa forme cristalline, il est blanc.
Masse moléculaire
69 6182 g / mol.
Saveur
Légèrement amer
Densité
-Cristallin: 2,46 g / ml.
-Vitreux: 1,80 g / ml.
Point de fusion
Il n'a pas de point de fusion entièrement défini, car il dépend de la cristalline ou du vitré. La forme purement cristalline fond à 450 ° C; Cependant, la forme vitreuse fond en une plage de température qui couvre de 300 à 700 ° C.
Point d'ébullition
Encore une fois, les valeurs rapportées ne correspondent pas à cette valeur. Apparemment, l'oxyde de bore liquide (fondu de ses cristaux ou de son verre) bouillonne à 1860 ° C.
La stabilité
Il doit être maintenu au sec, car il absorbe l'humidité pour se transformer en acide borique, B (OH)3.
Nomenclature
L'oxyde de boro peut être nommé d'autres manières, comme:
-Trioxyde de diboro (nomenclature systématique).
-Oxyde de bore (III) (nomenclature des stocks).
-Oxyde borique (nomenclature traditionnelle).
Applications
Certaines des utilisations de l'oxyde de bore sont:
Synthèse de Boro Trihalogogenuros
De b2SOIT3 peut être synthétisé par Trihalogogenuros de Boro, bx3 (X = f, cl y br). Ces composés sont des acides Lewis, et avec eux, il est possible d'introduire des atomes de bore à certaines molécules pour obtenir d'autres dérivés avec de nouvelles propriétés.
Il peut vous servir: Ions polyiatomiques: liste et exercicesInsecticide
Un mélange solide avec de l'acide borique, b2SOIT3-B (oh)3, représente une formule utilisée comme insecticide domestique.
Solvant d'oxydes métalliques: formation de verre, céramique et alliages de bore
L'oxyde de bore liquide est capable de dissoudre les oxydes métalliques. De ce mélange résultant, une fois refroidi, des solides composés de bore et de métaux sont obtenus.
En fonction de la quantité de b2SOIT3 Utilisé, ainsi que la technique, et le type d'oxyde métallique, une riche variété de verre (borosilicats), de céramique (nitrures et carbures de bore) et des alliages peuvent être obtenus (si seuls les métaux sont utilisés).
En général, le verre ou la céramique acquièrent une plus grande résistance et force, ainsi que une plus grande durabilité. Dans le cas du verre, ils finissent par être utilisés pour les lentilles optiques et de télescope, et pour les appareils électroniques.
Classeur
Dans la construction de fours de fonderie en acier, des briques réfractaires avec du magnésium sont utilisées. En eux, l'oxyde de bore est utilisé comme liant, aidant à les garder fortement unis.
Les références
- Oxyde borique. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Oxyde borix. 20 Mule Team Borax. Récupéré de: borax.com

