Atome de carbone
- 2476
- 207
- Raphaël Meyer
Nous expliquons quel est l'atome de carbone, sa structure électronique, ses caractéristiques et son hybridation orbitale.
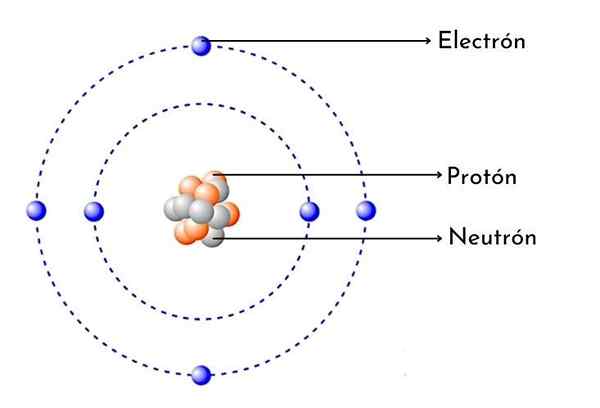
 Schéma d'atome de carbone
Schéma d'atome de carbone Qu'est-ce que l'atome de carbone?
Le carbone est l'élément numéro 6 du tableau périodique et est l'un des éléments les plus importants qui existent. Son importance provient d'une chimie très riche et variée qui fait former cet élément Base de vie sur la planète Terre, comme nous le savons.
Il s'agit d'un non-métal appartenir à Groupe 14 du tableau périodique (ancien groupe 4A) et la deuxième période. Dans sa forme naturelle, il est associé au charbon (à la fois minéral et légume) et à la suie, dans laquelle il est principalement sous forme de graphite ou d'autres alotrope.
Il Atome de carbone C'est parmi les plus petits du tableau périodique. C'est un atome tétravalent, c'est-à-dire qu'il peut former jusqu'à quatre liens avec d'autres atomes égaux ou différents du même.
Le carbone est d'une grande importance pour les humains. C'est l'une des principales composantes de notre corps, formant plus de 19% de sa masse. De plus, il a également plusieurs applications technologiques dérivées de ses propriétés atomiques.
Caractéristiques de l'atome de carbone
- L'atome de carbone est un non-métal: Le carbone est un élément non métallique qui peut être combiné avec de nombreux autres éléments du tableau périodique. Les atomes de carbone peuvent acquérir ou donner des électrons à d'autres atomes, devenant des anions ou des cations respectivement.
- Il a 6 protons dans son noyau: Le nombre atomique de carbone est de 6, ce qui signifie qu'il a 6 protons dans son noyau. Cela signifie également qu'un atome de carbone neutre a 6 électrons autour du noyau.
Peut vous servir: séparation magnétique- Il appartient au bloc P du tableau périodique: La configuration électronique du carbone dans son état fondamental est 12 2s2 2 P2. Comme on peut le voir, les derniers électrons de Valencia sont situés dans des orbitales P, de sorte que le carbone appartient au bloc P du tableau périodique.
- Les valences de l'atome de carbone sont +2, +4 et -4: La couche de valence en carbone ne manque que 4 électrons pour remplir complètement et donc acquérir la configuration électronique du gaz néon noble. Pour cette raison, le carbone peut former l'anion en carbure, C4-, qui a 4 électrons de plus que du carbone neutre. D'un autre côté, l'atome de carbone peut également perdre les deux électrons 2p, devenant ainsi le cation carbone (C2+), ou les 4 électrons de Valencia, devenant le cation carbonique (c4+).
- Vous pouvez former plusieurs alotropes: Le carbone élémentaire peut être trouvé dans deux formes naturelles courantes qui sont du graphite et du diamant, qui ont des propriétés radicalement opposées. De plus, vous pouvez former différents gars, carbone et nanotubes de graphène.
Les trois isotopes de l'atome de carbone
Tous les atomes de carbone ont six protons dans leur noyau, mais tous n'ont pas le même nombre de neutrons, donnant naissance à trois isotopes:
- Carbone-12 (12C): C'est le plus stable et le plus abondant (environ 98,9%). Il a 6 neutrons dans son noyau.
- Carbone-13 (13C): Il a 7 neutrons.
- Carbone-14 (14C): Il s'agit d'utiliser les dates d'anciennes objets radioactifs pour les anciens objets.
Structure électronique de l'atome de carbone
Comme chaque atome de carbone, il a six protons positifs dans son noyau, puis il a également 6 électrons avec une charge négative tournant.
Peut vous servir: Aliquot (chimie)La façon dont ces électrons sont distribués ou la configuration électronique de l'atome de carbone est:
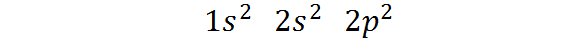
Cette configuration électronique indique que Le carbone a 2 électrons dans l'orbital 1s, Deux électrons en orbital 2s, et Deux électrons distribués entre les trois orbitales 2p.
D'un autre côté, la couche de valence pour le carbone est la couche L, qui correspond au niveau n = 2, car c'est la couche de niveau le plus élevé contenant des électrons. Comme nous pouvons le voir, le carbone a au total 4 électrons au niveau 2, Alors nous disons que Il a 4 électrons de valence.
C'est la raison pour laquelle le carbone est situé dans lequel il s'appelait auparavant le groupe 4A du tableau périodique.
Hybridation orbitale atomique dans l'atome de carbone
Les atomes réagissent et se lient les uns aux autres via leurs électrons de valence et les orbitales qu'ils occupent. Cependant, ces derniers n'ont pas toujours une orientation adéquate pour former les liens nécessaires.
La théorie des liens de Valence indique que les atomes mélangent leurs orbitales atomiques pour former de nouvelles orbitales hybrides qui ont des conseils appropriés. Ce processus est appelé hybridation.
Selon le nombre d'atomes auxquels un atome de carbone est lié, il mélangera ou hybridera un nombre différent d'orbitales atomiques purs. Cela donne naissance à Trois hybridations différentes, qui sont:
Sp
Se produit lorsque le carbone est lié uniquement à Deux atomes. Dans ce cas, les orbitaux S avec l'une des trois orbitales p sont mitigées, donnant naissance à deux orbitales SP qui pointent dans des directions opposées (180º l'une de l'autre).
Peut vous servir: baromètre MercuryLes deux orbitales P laissées sans mélange sont utilisées pour former des liaisons PI. L'atome de carbone peut se former Un triple lien (qui contient deux liaisons Pi) avec un seul atome, ou peut former Deux doubles liens, un avec chaque atome (et avec un lien pi chacun).
Sp2
Quand Carbon veut rejoindre Trois atomes, Vous avez besoin de trois orbitales hybrides, alors mélangez trois orbitales pures: les orbitaux et les deux orbitales P. Cela génère trois orbitales hybrides SP2 ce point vers les coins d'un triangle équilatéral.
L'orbital P qui n'a pas été utilisé, peut former une liaison PI avec l'un des trois atomes liés, donnant lieu à une double liaison.
Sp3
Quand le carbone va être lié à Quatre atomes, Mélanger les 4 orbitales pures de votre couche de valence pour générer 4 SP orbitaux hybrides3. Ceux-ci pointent vers les sommets d'un tétraèdre ordinaire.
Comme il n'y a pas d'orbitales pour former des obligations PI, un carbone avec une hybridation SP3 Vous ne pouvez former que quatre liens simples et aucun lien multiple.
Les références
- Britannica, les éditeurs de l'Encyclopaedia. Carbone - faits, utilisations et propriétés. Pris de https: // www.Britannica.com / science / carbone-chimical-element
- Laboratoire de surveillance mondiale. (s. F.). Gaz à effet de serre du cycle du carbone. Pris de https: // gml.Noaa.Gov / CCG / isotopes / chimie.Html

