Éther éthylique
- 2280
- 406
- Lucas Schneider
 L'éther éthylique est un liquide volatil et inflammable qui a servi d'anesthésique au XIXe siècle
L'éther éthylique est un liquide volatil et inflammable qui a servi d'anesthésique au XIXe siècle Qu'est-ce que l'éther éthylique?
Il éther éthylique, Également connu sous le nom d'éther Dietyl, c'est un composé organique dont la formule chimique est C4HdixSOIT. Il se caractérise par un liquide incolore et volatil, et, par conséquent, ses bouteilles doivent être conservées aussi étroitement que possible.
Cet éther. C'est-à-dire qu'ils ont la formule ROR ', où r et r' représentent différents segments gazeux. Et comme décrit par son deuxième nom, Dietyl Ether, sont deux radicaux -éthyles qui sont liés à l'atome d'oxygène.
Initialement, l'éther éthylique a été utilisé comme anesthésique général, introduit en 1846 par William Thomas Green Morton. Cependant, en raison de son inflammabilité, son utilisation a été jetée, la remplaçant par d'autres anesthésiques moins dangereux.
Ce composé a également été utilisé pour calculer le temps de circulation sanguine, lors de l'évaluation du statut cardiovasculaire du patient.
Structure éthylique d'éther
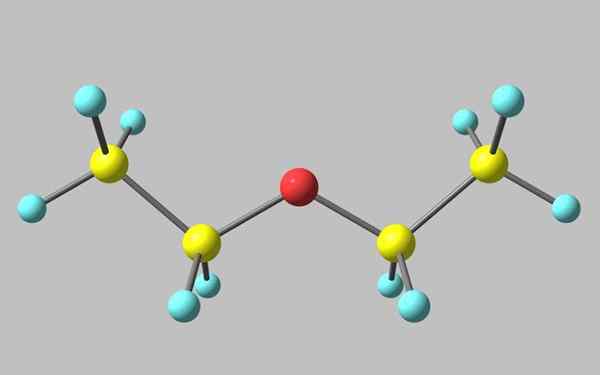 Structure chimique de l'éther éthylique
Structure chimique de l'éther éthylique Dans l'image supérieure, il y a une représentation avec un modèle de sphères et de barres de la structure moléculaire de l'éther éthylique.
Comme on peut le voir, la sphère rouge, correspondant à l'atome d'oxygène, a deux groupes éthyliques liés aux deux côtés. Tous les liens sont simples, flexibles et libres de rotation autour des axes σ.
Ces rotations proviennent des stéréoisomères connus sous le nom de conformères, que plus que les isomères sont des états spatiaux alternatifs. La structure de l'image correspond exactement à l'anti-conforme, dans lequel tous ses groupes d'atomes sont échelonnés (séparés les uns des autres).
L'autre confruero est éclipsé, et bien qu'il ne s'agisse pas de son image disponible, il suffit de le visualiser avec un U-engendré. Aux extrémités supérieures de l'u, les groupes méthyles seraient situés, -ch3, qui subirait des répulsions stériques (ils entreraient en collision dans l'espace).
Peut vous servir: Faraday constantePar conséquent, on peut s'attendre à ce que la molécule de Cho3Ch2Och2Ch3 adopter l'anti-formation la plupart du temps.
Propriétés physiques et chimiques du éther éthylique
Autres noms
- L'éther diéthylique
- Etoxytano
- Oxyde d'éthyl
Formule moléculaire
C4HdixO o (c2H5)2SOIT.
Poids moléculaire
74.14 g / mol.
Aspect physique
Liquide incolore.
Odeur
Doux et épicé.
Saveur
Brûler et doux.
Point d'ébullition
94.3 ° F (34.6 ° C) à 760 mm Hg.
Point de fusion
-177.3 ° F (-116.3 ° C). Cristaux stables.
point d'allumage
-49 ° F (récipient fermé).
Solubilité dans l'eau
6.04 g / 100 ml à 25 ° C.
Solubilité dans d'autres liquides
Discible avec l'aliphatique à chaîne courte, le benzène, le chloroforme, l'éther d'huile, le solvant de graisse, de nombreuses huiles et l'acide chlorhydrique concentré.
Soluble en acétone et très soluble dans l'éthanol. Il est également soluble dans l'essence, le benzène et les huiles.
Densité
0.714 mg / ml à 68 ° F (20 ° C).
Densité de vapeur
2.55 (par rapport à l'air pris avec la densité 1).
La pression de vapeur
442 mm Hg à 68 ° F. 538 mm Hg à 25 ° C. 58,6 kPa à 20 ° C.
La stabilité
Il est lentement oxydé par l'action de l'air, de l'humidité et de la lumière avec la formation de peroxydes.
La formation de peroxydes peut se produire dans des conteneurs d'éther qui ont été ouverts et restent en stock pendant plus de six mois. Les peroxydes peuvent déclencher des frottements, un impact ou un chauffage.
Son contact avec: le zinc, les halogènes, les oxihaluros non métalliques, les agents oxydants puissants, le chlorure de chromyle, les huiles de treemine, les nitrates et les chlorures métalliques doivent être évités.
Auto allumage
356 ° F (180 ° C).
Décomposition
Quand il se réchauffe, il tombe en panne, émettant un acre et de la fumée irritante.
Gelée
0.2448 Équilibre à 20 ° C.
Chaleur de combustion
8.807 kcal / g.
Il peut vous servir: einstenio (s): structure, propriétés, obtention, utilisationsChaleur de vaporisation
89.8 chaux / g A 30 ° C.
Tension superficielle
17.06 Dynas / cm à 20 ° C.
Potentiel d'ionisation
9.53 EV.
Seuil d'odeur
0.83 ppm (la pureté n'est pas donnée).
Indice de réfraction
1.355 à 15 ° C.
Obtenir le éther éthylique
L'éther éthylique d'alcool éthylique peut être obtenu, en présence d'acide sulfurique comme catalyseur. L'acide sulfurique dans un milieu aqueux dissocie la production de l'ion hydronium, H3SOIT+.
Dans le processus opposé, c'est-à-dire l'hydratation de l'éthylène en phase de vapeur, l'éther éthylique peut se former en tant que produit collatéral en plus de l'alcool éthylique. En fait, cette route synthétique produit la plupart de ce composé organique.
Toxicité éther éthylique
Il peut produire des irritations de la peau et des yeux. Le contact cutané peut produire sa résection et sa fissuration. L'éther ne pénètre généralement pas la peau, car elle est rapidement évaporée.
L'irritation des yeux causée par l'éther est généralement légère, et en cas d'irritation sévère, les dommages sont généralement réversibles.
Son ingestion produit des effets narcotiques et une irritation de l'estomac. L'ingestion sévère peut causer des lésions rénales.
L'inhalation de l'éther peut provoquer une irritation du nez et de la gorge. Dans le cas d'une inhalation d'éther, elle peut être produite: somnolence, excitation, étourdissements, vomissements, respiration irrégulière et augmentation de la salivation.
Une exposition élevée peut entraîner une perte de connaissances et même la mort.
L'OSHA établit une limite d'exposition au travail de 800 ppm en moyenne, pendant un changement de 8 heures.
Niveaux d'irritation oculaires: 100 ppm (humains). Niveaux d'irritation des yeux: 1200 mg / m3 (400 ppm).
Utilisations / applications du éther éthylique
Solvant organique
C'est un solvant organique utilisé pour dissoudre le brome, l'iode et d'autres halogènes. La plupart des lipides (graisses), des résines, des caoutchoucs purs, des alcaloïdes, des caoutchoucs, des parfums, de l'acétate de cellulose, du nitrate de cellulose, des hydrocarbures et des colorants.
Il peut vous servir: pas de métaux: historique, propriétés, groupes, utilisationsDe plus, il est utilisé dans l'extraction des ingrédients actifs des tissus animaux et des plantes, car il a moins de densité que l'eau et flotte dessus, laissant les substances souhaitées dissoutes dans l'éther.
Anesthésie générale
Il est utilisé comme anesthésie générale depuis 1840, remplaçant le chloroforme pour avoir un avantage thérapeutique. Cependant, c'est une substance inflammable et, par conséquent, trouvent de graves difficultés dans son utilisation dans les zones cliniques.
De plus, il produit chez les patients certains effets secondaires postopératoires indésirables, tels que les nausées et les vomissements.
Pour ces raisons, l'utilisation de l'éther a été rejetée comme anesthésie générale, la remplaçant par d'autres anesthésiques tels que Halotano.
Éther l'esprit
Éthanol mixte.
Évaluation de la circulation sanguine
L'éther a été utilisé pour évaluer la circulation sanguine entre un bras et les poumons. L'éther est injecté dans un bras, emmenant le sang vers l'atrium droit, puis vers le ventricule droit et de là vers les poumons.
Le temps qui s'échappe de l'injection de l'éther, à la capture de l'odeur de l'éther dans l'air expiré, est d'environ 4 à 6 s.
Laboratoires pédagogiques
L'éther est utilisé dans les laboratoires d'enseignement dans de nombreuses expériences. Par exemple, dans la démonstration des lois de Mendel de la génétique.
L'éther est utilisé pour engourdir les mouches de genre Drosophile et permettre aux croisements nécessaires entre eux, pour mettre en évidence les lois de la génétique.
Les références
- Graham Salomons t.W., Craig B. Fryhle. Chimie organique. Amines. Wiley Plus.
- Ether ethher. Récupéré de Britannica.com

