Théorie orbitale moléculaire

- 3754
- 902
- Prof Ines Gaillard
Qu'est-ce que la théorie orbitale moléculaire?
La Théorie orbitale moléculaire (Tom) Il s'agit d'un modèle mathématique développé pour expliquer les propriétés physicochimiques des molécules, telles que l'absorption et l'émission de rayonnement, la conductivité électrique, ainsi que la nature électronique de ses liens. Cela considère, contrairement à la théorie des liens Valencia (TEV), que les électrons sont déplacés dans toute la molécule, sans être situés de manière probabiliste dans les liens.
Par conséquent, la théorie orbitale moléculaire applique les mêmes principes quantiques qui dictent les fonctions d'onde pour les orbitales atomiques, décrivant ainsi l'état d'énergie des électrons dans les atomes; Ce n'est que maintenant, traite les orbitales moléculaires SO, provenant des combinaisons linéaires des orbitales atomiques des atomes.
 Le paramagnétisme de l'oxygène liquide, et donc son attraction pour les aimants, s'explique grâce à la théorie orbitale moléculaire. Source: Pieter Kuipeper via Wikipedia.
Le paramagnétisme de l'oxygène liquide, et donc son attraction pour les aimants, s'explique grâce à la théorie orbitale moléculaire. Source: Pieter Kuipeper via Wikipedia. La théorie orbitale moléculaire fonctionne alors, en travaillant avec des orbitales moléculaires, leurs distributions électroniques et spatiales, ainsi que les diagrammes de leurs énergies respectives, qui permettent d'observer les écarts d'énergie qui les séparent. Surtout, explique le paramagnétisme de certaines substances, telles que l'oxygène moléculaire à l'état liquide (voir ci-dessus).
Le o2, Décrit par les structures de Lewis et la théorie des liens de Valencia, il a tous ses électrons appariés, donc en théorie, il devrait être diamagnétique. Cependant, dans la pratique, il a été démontré qu'il est en fait paramagnétique, c'est-à-dire qu'il a des électrons manquants; Plus précisément une paire d'électrons manquants.
De la construction du diagramme OM (orbitales moléculaires) pour le o2, Une molécule diatomique homonucléaire, on peut voir qu'il y aura effectivement deux électrons manquants à haute énergie. Non seulement cela, mais la rotation et la position de ces électrons dans les OM expliquent également d'autres états électroniques de l'OR2 (seul).
Les autres triomphes les plus importants de la théorie orbitale moléculaire sont qu'il aide à prédire l'existence possible de molécules diatomiques, ainsi que leur stabilité relative. Ainsi, la théorie orbitale moléculaire est juste dans la prédiction des molécules telles que b2 et li2, même lorsqu'ils ne peuvent détecter que dans la phase de vapeur à des températures élevées. De plus, cette théorie rejette l'existence de l'hypothèse que j'ai2 ou ne2.
Types de liaisons moléculaires et orbitales
Comme pour la théorie des liens de Valence, dans la théorie orbitale moléculaire, plusieurs types de liens sont considérés en fonction de la directionnalité du chevauchement des orbitales atomiques participant à la liaison chimique. Parmi les plus importants et les plus présents dans la nature moléculaire, nous avons les liaisons Sigma et Pi.
Sigma
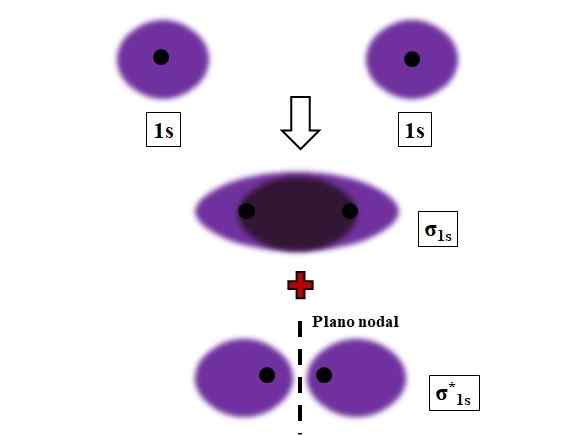 Formation de liens σ1s et σ1s * pendant le chevauchement de deux orbitales atomiques 1. Source: Gabriel Bolívar.
Formation de liens σ1s et σ1s * pendant le chevauchement de deux orbitales atomiques 1. Source: Gabriel Bolívar. Sigma, σ liais.
Considérez, par exemple, la liaison σ formée lorsque deux orbitales atomiques 1S, selon un atome d'hydrogène, sont à proximité d'une très courte distance (image ci-dessus). Parce que les orbitales 1 sont symétriques, leur chevauchement sera toujours frontal; Par conséquent, ils généreront toujours des orbitales moléculaires σ1 et σ1*.
Notez maintenant que l'orbital moléculaire σ1 montre une densité électronique concentrée dans l'espace qui sépare les deux noyaux. Cela signifie que dans une orbitale σ1 La probabilité de trouver un électron est maximale dans cette région de la molécule. Les électrons de σ1 Ils sont déplacés dans tout l'espace qui couvre la couleur violette.
D'un autre côté, dans l'orbital σ1* Nous avons un plan nodal entre les deux noyaux. Cela signifie que la probabilité de trouver un électron entre cet espace est égale à zéro. Notez que dans l'orbital σ1* Les électrons décrivent des positions autour de chacun des deux noyaux; pas autour de la molécule dans son ensemble.
Peut vous servir: radio: structure, propriétés, utilisations, obtentionPi
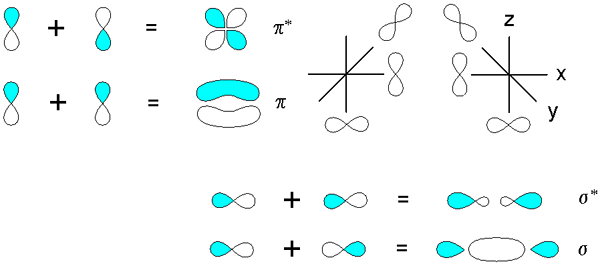 Obligations Sigma et Pi dérivées du chevauchement des orbitales p. Source: v8rik à in in.Wikipedia, cc by-sa 3.0, via Wikimedia Commons
Obligations Sigma et Pi dérivées du chevauchement des orbitales p. Source: v8rik à in in.Wikipedia, cc by-sa 3.0, via Wikimedia Commons Considérez maintenant les liaisons et orbitales moléculaires. Ceux-ci se produisent lorsque le chevauchement des orbitales se produit dans une direction perpendiculaire à l'axe internucléaire, qui est arbitrairement fixé dans l'un des axes du plan cartésien. En supposant que nous parlons d'une orbitale 2pX, L'orbital 2pet Il sera libre d'établir un lien PI (voir lobes bleus et blancs).
Lorsque deux orbitales 2pet Deux orbitales moléculaires proviennent: π2y et π2y* Le premier a la densité électronique la plus élevée et en dessous de l'axe internucléaire, tandis que le second ressemble à une fleur à quatre pieds, où la probabilité de trouver des électrons est beaucoup plus bas.
D'un autre côté, les Orbitals 2P, pour dire 2pX, Ils peuvent également se chevaucher frontalement pour créer une liaison σ et deux orbitales moléculaires σ2px et σ2px*. Comme dans les cas de σ1 et σ1*, L'orbital σ2px montre une plus grande densité électronique entre les deux noyaux; qui est contraire à σ2px*, où les électrons sont orientés vers les côtés de l'extérieur.
Lien
Les orbitales moléculaires de bilan sont celles qui contribuent à la stabilité de la molécule. C'est-à-dire qu'ils doivent avoir moins d'énergie par rapport aux orbitales atomiques des atomes individuels avant de lier et de former la molécule. Dans ces orbitales, les électrons sont déplacés par toutes les dimensions de la molécule dans son ensemble.
Dans les diagrammes OM, ceux-ci seront toujours situés sous les orbitales atomiques qui se sont combinées pour les former. Cela sera vu plus en détail dans les sections suivantes.
Anti-hut
Les orbitales moléculaires anti-hébergeantes, en revanche, sont celles qui déstabilisent la molécule. Ils sont symbolisés par un astérisque (*), et leurs énergies sont plus élevées que celles des orbitales atomiques qui les ont créées. Dans ces orbitales, les électrons sont déplacés de manière assez irrégulière, comme si la molécule était fragmentée électroniquement.
Dans les diagrammes OM, ils seront toujours situés au-dessus des orbitales atomiques qui se sont combinées pour les former.
Non lié
Pendant ce temps, les orbitales non rond, ainsi que leurs électrons, sont celles qui ne contribuent pas ou ne nuisent pas à la stabilité de la molécule. Ses énergies sont très similaires à celles des orbitales atomiques.
Commande de liaison
L'ordre des liens devient dans la théorie de l'orbitale moléculaire, tout comme le numéro de lien se trouve dans la théorie du lien de valence: une mesure de la force du lien dans une molécule. Ainsi, un ordre de lien égal à 1 correspond à un lien simple (-). Et une commande de lien (ou.e) égal à 2, correspond à une double liaison (=). Bientôt.
Cet ordre est déterminé à partir du comptage des électrons dans les diagrammes OM pour une molécule particulière. Pour ce faire, la formule suivante doit être appliquée:
soit.E = (Nombre d'électrons liés - Nombre d'électrons anti-hut) / 2
Les électrons de liaison contribuent à la molécule pour se stabiliser, tandis que les électrons anti-fierté le déstabilisent. Par conséquent, plus les électrons anti-sung, plus le ou.E, et la molécule aura tendance à être très instable. Quand le o.E est égal à 0, cela signifie que la molécule n'existe pas (ou du moins en théorie).
Diagrammes OM
Dans les diagrammes OM, les énergies des orbitales moléculaires sont représentées, et son remplissage électronique est également visualisé, ce qui obéit aux règles d'Aufbauf et de Sinn, ainsi que le principe d'exclusion de Pauling. Considérez, par exemple, les deux diagrammes suivants:
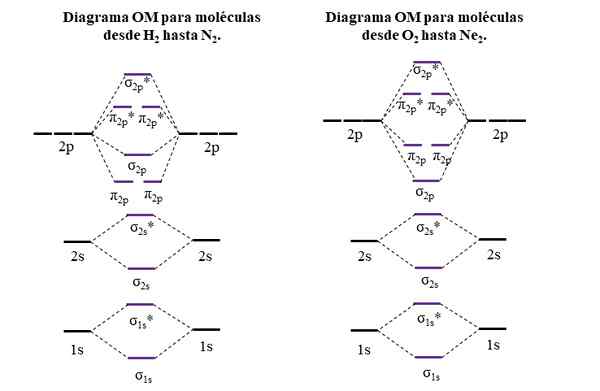 Diagrammes OM pour les molécules de la première et de la deuxième période du tableau périodique. Source: Gabriel Bolívar.
Diagrammes OM pour les molécules de la première et de la deuxième période du tableau périodique. Source: Gabriel Bolívar. Les lignes horizontales sur les côtés, noires, représentent les énergies des orbitales atomiques. Au lieu de cela, les lignes horizontales centrales, violet, sont les énergies des orbitales moléculaires. Notez comment la liaison et les OM anti-agent sont distribués (*) par rapport aux orbitales atomiques des atomes individuels.
Il peut vous servir: un groupe amino (NH2): structure, propriétés, exemplesNotez également que dans le bon diagramme, l'OM σ2 P Ils changent de lieu avec π2 P. Cela se produit avec les molécules de o2, F2, et l'hypothétique NE2.
Exemples
Dans les exemples suivants, l'OM procédera aux électrons, calculera l'ordre de liaison et fera des prédictions sur la force de la liaison ou la stabilité de la molécule en question.
H2
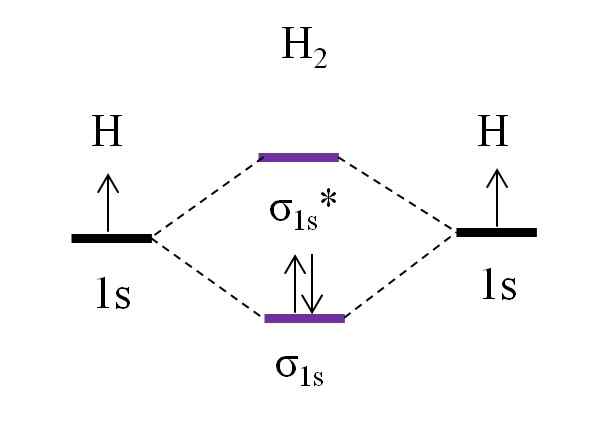 Diagramme OM pour la molécule de dihydrogène. Source: Gabriel Bolívar.
Diagramme OM pour la molécule de dihydrogène. Source: Gabriel Bolívar. En commençant par la molécule la plus simple, celle du dihydrogène, h2, Deux atomes H sont liés en combinant leurs deux orbitales atomiques 1 pour former deux orbitales moléculaires σ1 et σ1*. Les deux électrons procèdent ensuite à remplir les orbitales moléculaires.
D'abord l'orbital σ est rempli1, Parce que c'est la moindre énergie (règle aufbauf). Ensuite, le deuxième électron doit finir de remplir l'orbital σ1 Avant de gravir l'orbital σ1* (Règle du puits). Et enfin, ce deuxième électron guide sa rotation dans la direction opposée au premier électron (principe d'exclusion de Pauling). Ainsi, les deux électrons sont situés dans l'orbital lié σ1.
Qu'en est-il de l'ordre de lien? Dans le lien orbital moléculaire σ1 Nous avons 2 électrons; Tandis que dans l'orbitale moléculaire anti-cohel σ1* Nous n'en avons pas. Par conséquent, le calcul serait:
soit.E = (2-0) / 2
= 1
Être ou.Et égal à 1, cela signifie que le lien qui unit les deux atomes d'hydrogène est simple: H-H. Généralement, si cette valeur est égale ou supérieure à 1, il est dit que la molécule existe et est stable.
Il2
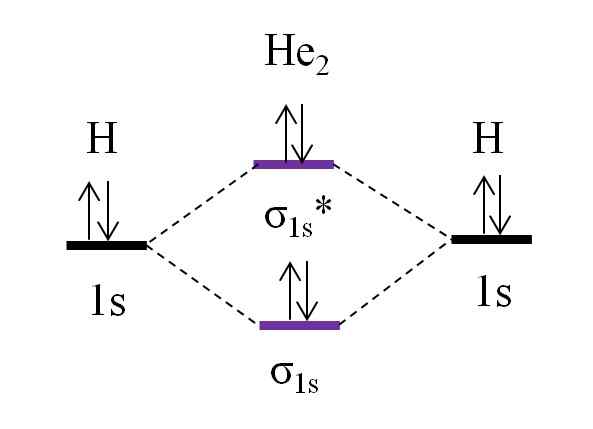 Diagramme OM pour une molécule de dihelio hypothétique. Source: Gabriel Bolívar.
Diagramme OM pour une molécule de dihelio hypothétique. Source: Gabriel Bolívar. Supposons maintenant que vous ayez la molécule de lui2. Ci-dessus, nous voyons que son diagramme OM est très similaire au H2, Avec 2 électrons supplémentaires situés dans l'orbital σ1*. Lorsqu'il y a un total de 4 électrons ajoutant les deux atomes, il doit également y avoir 4 électrons dans toutes les orbitales moléculaires résultantes.
Déterminer le o.E pour le i he2 nous aurons:
soit.E = (2-2) / 2
= 0
Cela signifie qu'il n'y a pas de lien possible que les deux atomes d'hélium. En fait, à ce jour, l'existence de cette molécule n'a pas été identifiée, ce qui est d'accord avec les prédictions de la théorie orbitale moléculaire.
B2
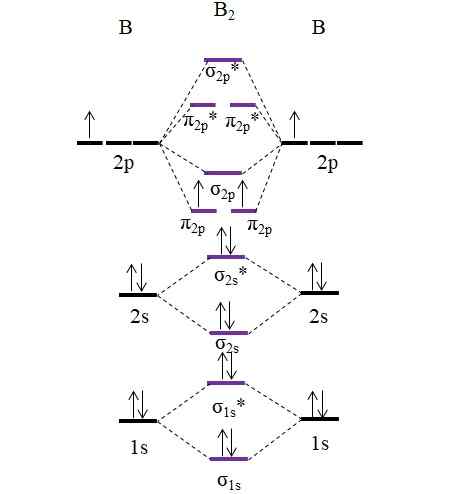 Diagramme OM pour la molécule B2. Source: Gabriel Bolívar.
Diagramme OM pour la molécule B2. Source: Gabriel Bolívar. Notez que dans la formation d'orbitales moléculaires, les électrons des couches internes sont également pris en compte; Non seulement ceux de Valence.
Ainsi, dans l'exemple de la molécule de diboro, b2, Chaque atome de bore contribue 5 électrons au total, dont 3 de Valence; Ce sont ceux de leurs orbitales 2s et 2p. Les deux électrons des orbitales 2p sont positionnés dans différentes orbitales moléculaires π2 P Avec épines parallèles (règle de l'évier).
Nous procédons ensuite à calculer l'ordre de lien:
soit.E = (6-4) / 2
= 1
Par conséquent, la molécule devrait avoir un lien B-B simple. Le b2 C'est une molécule qui n'existe qu'au stade vapeur à des températures très élevées, car le bore dans des conditions normales adopte des structures et des conceptions de réseau plus complexes.
C2 et C22-
Considérez d'abord le diagramme OM pour la molécule C2:
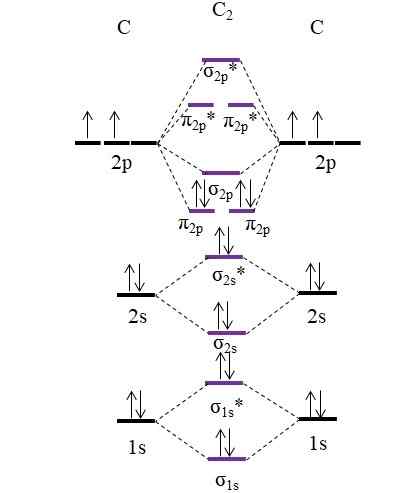 Diagramme OM pour la molécule C2. Source: Gabriel Bolívar.
Diagramme OM pour la molécule C2. Source: Gabriel Bolívar. Maintenant, les deux nouveaux électrons fournis par les atomes de carbone sont à nouveau positionnés dans les orbitales moléculaires π2 P Mais avec des tours opposés (principe d'exclusion de Pauling).
Déterminer votre ordre de lien que nous aurons:
soit.E = (8-4) / 2
= 2
Notez que les orbitales moléculaires π2 P Ajouter 4 électrons liant à la formule. Étant cet ordre égal à 2, cela signifie que la molécule C2 Il a une double liaison, c = c. Encore une fois, molécule C2, Également appelé carbone diatomique, il n'y a que la phase de vapeur à des températures élevées, et c'est l'une des formes de carbone les plus simples.
Et qu'en est-il de C22-? Votre diagramme OM est le suivant:
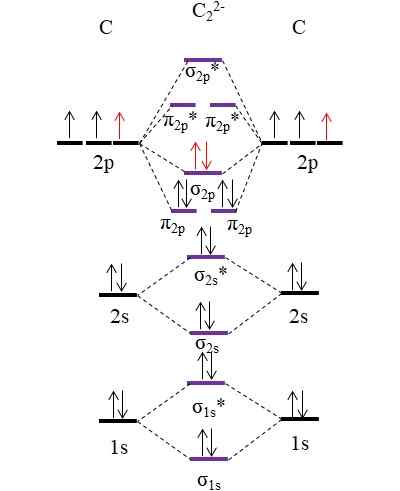 Diagramme OM pour l'anion C22-. Source: Gabriel Bolívar.
Diagramme OM pour l'anion C22-. Source: Gabriel Bolívar. Les deux nouveaux électrons (flèches rouges) sont positionnés dans l'orbital moléculaire de liaison σ2 P. Cela suppose ainsi que chaque atome de carbone contribue à l'une des deux charges négatives (pour un état d'oxydation de -1).
Peut vous servir: Mercury fulminate: structure, propriétés, obtention, utilisationsCalcul de votre commande de lien que nous aurons:
soit.E = (10-4) / 2
= 3
C'est-à-dire l'anion c22-, Également appelé anion acétyluro, il a un triple lien, [C≡C]2-. Il s'agit d'un anion relativement stable avec une grande force de liaison; Cependant, selon ses ions homologues, il peut provenir des composés explosifs.
N2 et n2+
La célèbre molécule d'azote, n2, Il peut également être décrit parfaitement en utilisant des diagrammes orbitaux moléculaires:
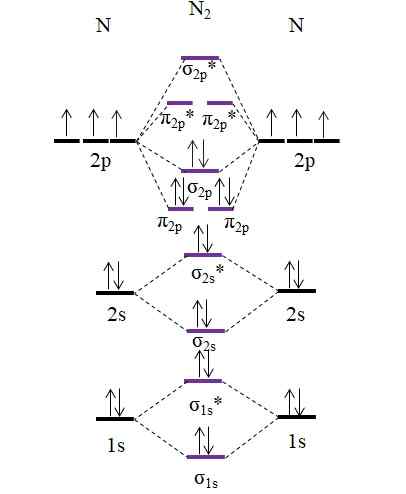 Diagramme OM pour la molécule N2. Source: Gabriel Bolívar.
Diagramme OM pour la molécule N2. Source: Gabriel Bolívar. Notez que ce diagramme est exactement le même que pour l'anion C22-. Cela signifie que n2 et C22- Ils sont isolécortives. Cependant, un tel fait n'implique pas que les deux espèces se comportent de la même manière. Alors2, neutre, est beaucoup plus stable que c22-, négatif, même si les deux ont un ordre de lien égal à 3, n≡n.
Et qu'en est-il du cation n2+? Regardons votre diagramme OM:
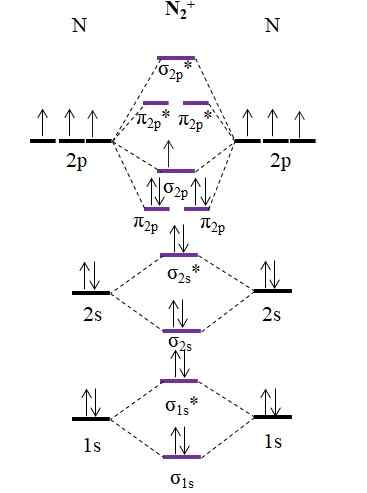 Diagramme OM pour le cation n2+. Source: Gabriel Bolívar.
Diagramme OM pour le cation n2+. Source: Gabriel Bolívar. Comme cation n2+ Il a un électron de moins, ceci est retiré l'orbital moléculaire σ2 P. Alors2 Il est diamagnétique, tandis que le n2+ C'est paramagnétique. Et son ordre de lien est:
soit.E = (9-4) / 2
= 2.5
Un lien 2 2.5 serait représenté avec deux lignes et un point. Cependant, une telle chose n'a pas beaucoup de sens dans la théorie de Valence ou dans les structures de Lewis. Parce que cet ordre de lien est inférieur à 3, la force du lien présent dans le n2+ est inférieur au n2, C'est donc plus instable.
SOIT2, SOIT22- je22+
Voyons maintenant une autre molécule très importante pour la vie: oxygène moléculaire ou diatomique, ou2. Selon la théorie de Valence et les structures de Lewis, elle devrait être diamagnétique; Mais expérimentalement il s'est avéré paramagnétique, il a donc disparu des électrons quelque part.
Ci-dessous, nous comparons les diagrammes OM pour le O2 et ions ou22- (oxyde) et o22+ (Oxydation):
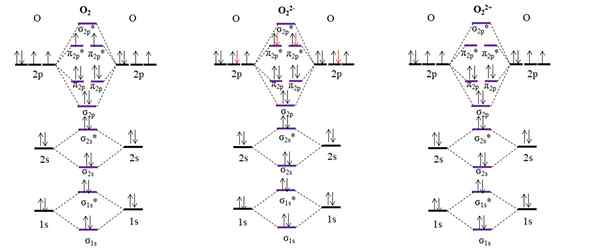 Diagrammes OM pour l'oxygène moléculaire et deux de ses ions principaux. Source: Gabriel Bolívar.
Diagrammes OM pour l'oxygène moléculaire et deux de ses ions principaux. Source: Gabriel Bolívar. Le diagramme OM pour le O2 Échantillon, contrairement aux précédents, que les orbitales moléculaires σ2 P et π2 P changer leur position énergétique. De plus, nous voyons efficacement qu'il y a deux électrons manquants dans les orbitales π2 P*, qui explique le caractère paramagnétique de l'oxygène (mentionné au début de l'article).
D'un autre côté, nous avons également le diagramme OM pour l'anion ou22-, Infiniment réparti dans le cosmos (lunes, planètes, comètes, astéroïdes, etc.). Il a deux électrons supplémentaires (flèches rouges), qui finissent de remplir les orbitales π2 P*, s'accoupler tous les électrons. Par conséquent, le ou22- C'est diamagnétique.
Nous considérons également le diagramme OM pour l'oxydation ou22+. Il a deux électrons de moins que le O2, laissant vide les orbitales π2 P*. Tous ses électrons sont appariés, et donc il est diamagnétique.
Lier les commandes pour le O2, SOIT22- je22+ Ils sont respectivement: 2 (o = o), 1 [o-o]2- et 3 [o≡o]2+. Par conséquent, le o22+ aurait le lien le plus fort.
Avantages et inconvénients
avantage
Parmi les avantages de la théorie orbitale moléculaire, nous pouvons citer ce qui suit:
-Il permet d'évaluer les commandes de liens qui n'auraient pas beaucoup de sens dans la théorie des liens de Valence
-Il est bien corrélé avec le diamagnétisme et le paramagnétisme des molécules
-La distance qui sépare les orbitales moléculaires dans les diagrammes est égale à ΔE et sert à expliquer le produit de transitions électroniques de l'absorption des photons
-S'applique non seulement aux molécules diatomiques homonucléaires, mais aussi aux molécules hétéronucléaires, telles que CO2 et benzène
-Il étend son modèle à d'autres types de composés, tels que des complexes inorganiques, il soutient donc la théorie du domaine des ligands
-La considération selon laquelle les électrons sont déplacés dans toute la molécule est pratique pour expliquer de nombreuses propriétés physicochimiques
Désavantages
Et parmi certains des inconvénients de la théorie orbitale moléculaire que nous avons, pour terminer:
-Il est très abstrait et nécessite une compréhension mathématique profonde pour la comprendre pleinement
-Diagrammes de moléculation comme co2, CO, H2Ou et autres, ils peuvent être trop fastidieux pour élaborer et expliquer
-Il ne dit rien sur des régions ou des liens spécifiques d'une grande molécule
-Il ne fournit pas non plus d'informations concernant la géométrie moléculaire (plan trigonal, plan carré, tétraédrique, etc.).
-Ce n'est pas aussi graphique que la théorie des liens de Valence
La théorie orbitale moléculaire, en conclusion, est une théorie qui complète la théorie du lien de Valence pour avoir un panorama plus large et plus complet du spectre moléculaire.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Théorie moléculaire orbitale. Récupéré de: dans.Wikipédia.org
- Stephen Lower. (7 septembre 2020). Théorie moléculaire orbitale. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Steven A. Hardinger. (2017). Théorie moléculaire orbitale. Récupéré de: Chemed.Chem.Purger.Édu
- Manuels de presse. (s.F.). Chapitre 8: Théorie moléculaire orbitale. Récupéré de: OpenTextBC.CA

