Sulfure de zinc (ZN)
- 690
- 0
- Louna Baron
 Sulfure de zinc. Source: Wikimedia Commons
Sulfure de zinc. Source: Wikimedia Commons Qu'est-ce que le sulfure de zinc?
Il Sulfure de zinc C'est un composé inorganique de la formule ZnS, formé par des cations Zn2+ et anions s2-. Il se trouve dans la nature principalement comme deux minéraux: le wurtzite et le spheny (ou le zinc mélange), ce dernier étant sa forme principale.
Le sphenhell est présenté dans la nature noire en raison des impuretés qu'il présente. Présente purement les cristaux blancs, tandis que le wurtzita a des cristaux blancs grisâtres.
Le sulfure de zinc est insoluble dans l'eau. Cela peut causer des dommages environnementaux, car il pénètre le sol et contamine les eaux souterraines et leurs courants.
Le sulfure de zinc peut survenir, entre autres réactions, la corrosion et la neutralisation.
Par corrosion:
Zn + H2S => zns + h2
Par neutralisation:
H2S + Zn (OH)2 => Zns + 2h2SOIT
Le sulfure de zinc est un sel phosphorescent, ce qui lui donne la capacité de multiples utilisations et applications. De plus, c'est un semi-conducteur et une photocation.
Structure de sulfure de zinc
Le sulfure de zinc adopte des structures cristallines régies par des attractions électrostatiques entre le cation Zn2+ et anion s2-. Ce sont deux: le mélange Spheny ou Zinc, et le Wurzita. Dans les deux ions minimiser les répulsions entre les ions égaux.
Le zinc mélange est le plus stable dans les conditions terrestres de pression et de température; Et le Wurzita, qui est moins dense, résulte de la réorganisation cristalline due à l'augmentation de la température.
Les deux structures peuvent coexister dans le même ZNS solide en même temps bien que, très lentement, le Wurzita finira par prédominance.
Zinc mélange
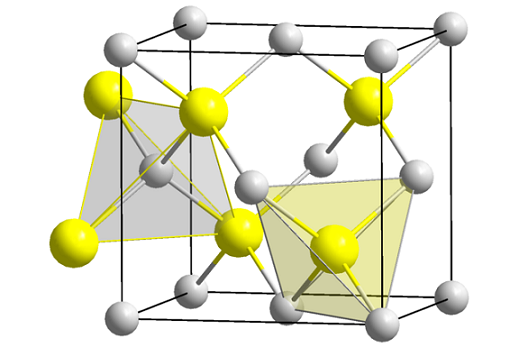
 Structure du zinc Blenda (Spheny). Source: Wikimedia Commons
Structure du zinc Blenda (Spheny). Source: Wikimedia Commons L'image supérieure montre la cellule cubique centrée sur les visages de la structure de mélange de zinc. Les sphères jaunes correspondent aux anions S2-, et les cations grises à Zn2+, Situé dans les coins et dans les centres des visages du cube.
Peut vous servir: Isobutil: nomenclature, formation, structure et caractéristiquesNotez les géométries tétraédriques autour des ions. Le zinc mélange peut également être représenté par ces tétraèdres, dont les trous à l'intérieur du verre ont la même géométrie (creux tétraédriques).
De plus, la proportion ZNS est remplie dans les cellules unitaires; c'est-à-dire une proportion 1: 1. Ainsi, pour chaque cation Zn2+ Il y a un anion s2-. À l'image, il peut sembler que les sphères grises abondent, mais en réalité lorsqu'elles sont dans les coins et au centre des faces de moyeu, elles sont partagées par d'autres cellules.
Par exemple, si les quatre sphères jaunes qui sont à l'intérieur de la boîte sont prises, les «pièces» de toutes les sphères grises autour devraient ajouter la même (et le faire), quatre. Ainsi, dans la cellule unitaire cubique, il y a quatre Zn2+ et quatre s2-, La proportion stoichiométrique ZNS est remplie.
De même, il est important de souligner qu'il y a des trous tétraédriques vers l'avant et derrière les sphères jaunes (l'espace qui les sépare les uns des autres).
Wurzita
 Structure de wurzite. Source: Wikimedia Commons
Structure de wurzite. Source: Wikimedia Commons Contrairement à la structure du zinc mélange, le Wurzita adopte un système cristallin hexagonal (image supérieure). C'est moins compact, donc le solide a moins de densité.
Les ions dans la Wurzita ont également des environnements tétraédriques et une proportion 1: 1 qui s'accompagne de la formule ZNS.
Propriétés du sulfure de zinc
Couleur
Il peut être présenté de trois manières:
-Le wurtzita, des cristaux blancs et hexagonaux.
-Le sphenhell, des cristaux blancs-cancan et des cristaux cubiques.
-En tant que poudre blanche blanche à grisâtre ou jaunâtre et cristaux jaunes cubes.
Point de fusion
1.700 ° C.
Solubilité dans l'eau
Pratiquement insoluble (0,00069 g / 100 ml à 18 ° C).
Solubilité
Insoluble chez les alcalis, soluble dans les acides minéraux dilués.
Densité
Sphères 4,04 g / cm3 et Wurtzita 4,09 g / cm3.
Dureté
Il a une dureté de 3 à 4 sur l'échelle Mohs.
La stabilité
Lorsque vous contenant de l'eau oxyde lentement le sulfate. Dans un environnement sec, c'est stable.
Décomposition
Lorsqu'il est chauffé à des températures élevées, il émet des vapeurs de zinc toxique et d'oxydes sulfureux.
Il peut vous servir: hydrure de sodium (NAH): propriétés, réactivité, dangers, utilisationsNomenclature du sulfure de zinc
La configuration électronique du Zn est [ar] 3ddix4s2. Lorsque vous perdez les deux électrons de l'orbitale 4S, c'est comme le Cation Zn2+ Avec ses orbitales de plein. Par conséquent, depuis électroniquement le Zn2+ C'est beaucoup plus stable que le Zn+, Il n'a qu'une valence de +2.
Par conséquent, il est omis pour la nomenclature des stocks, ajoutant sa valence enfermée entre parenthèses et avec des numéros romains: sulfure de zinc (II).
Nomenclatures systématiques et traditionnelles
Mais il existe d'autres moyens d'appeler ZNS en plus de celui déjà élevé. Dans le systématique, le nombre d'atomes de chaque élément est spécifié avec les numérateurs grecs, à la seule exception de l'élément à droite quand il n'est qu'un. Ainsi, le ZNS est nommé comme: chignonsulfure de zinc (et non monozinc monosulfuro).
En ce qui concerne la nomenclature traditionnelle, au zinc lorsqu'il a une seule valence de +2, il est ajouté en ajoutant le suffixe -co. Par conséquent, son nom traditionnel est: zínc sulfureICO.
Utilisation du sulfure de zinc
Comme pigments ou revêtements
Sachtolith
Le sachtholith est un pigment blanc fait avec du sulfure de zinc. Il est utilisé dans les putties, les mastiques, les scellants, les couvertures inférieures, les peintures en latex et la signalisation.
Son utilisation combinée à des pigments absorbants de lumière ultraviolette, comme le micro-titane ou les pigments transparents d'oxyde de fer, est nécessaire dans les pigments résistants aux intempéries.
ZNS et peintures en latex
Lorsque le ZNS est appliqué en latex ou en peintures texturées, il a une action de microbicide prolongée.
Cadres de fenêtres et d'avions
En raison de sa grande dureté et de la résistance à la rupture, à l'érosion, à la pluie ou à la poussière, il le rend adapté aux fenêtres infrarouges extérieures ou dans les cadres d'avion.
Revêtement et autres utilisations
Le ZNS est utilisé dans le revêtement des rotors utilisés dans le transport des composés, pour réduire l'usure. De plus, il est utilisé dans la production d'encres d'impression, de composés isolants, de pigmentation thermoplastique, de plastique résistant aux flammes et de lampes électroluminescentes.
Peut vous servir: Tunsen, caractéristiques, fonctions, exemples d'utilisationAppareils et écrans de vision nocturne
-Le sulfure de zinc peut être transparent, pouvoir être utilisé comme fenêtre pour l'optique visible et l'optique infrarouge. Il est utilisé dans les appareils de vision nocturne, sur les écrans de télévision, les écrans radar et les revêtements fluorescents.
Électroluminescence
Le dopage du ZN avec du Cu est utilisé dans la production de panneaux d'électroluminescence. De plus, il est utilisé dans la propulsion et la gravimétrie des fusées.
Pour sa phosphorescence
Sa phosphorescence est utilisée pour teindre les aiguilles de l'horloge et visualiser ainsi le temps dans l'obscurité; Également dans les peintures pour les jouets, les signaux d'urgence et les avis de circulation.
La phosphorescence permet d'utiliser du sulfure de zinc dans les tubes des rayons cathodiques et sur les écrans X-Ray pour briller en points sombres. La couleur de la phosphorescence dépend de l'activateur utilisé.
Semi-conducteur, photocation et catalyseur
- Le Spheny et le Wurtzite sont des semi-conducteurs à large bande. La sphalerite a une fente de bande EV de 3,54 eV, tandis que le Wurtzita a un bit de 3,91 eV-bande.
- Le ZNS est utilisé dans la préparation d'un photocatalyseur composé de CDS - ZN / Zirconium - phosphate de titane, utilisé pour la production d'hydrogène sous la lumière visible.
- Intervient comme catalyseur pour la dégradation des polluants organiques. Il est utilisé dans la préparation d'un synchroniseur de couleur dans les lampes LED.
- Ses nanocristaux sont utilisés pour la détection des protéines ultrasensibles. Par exemple, en émettant des points quantiques de ZNS. Il est utilisé dans la préparation d'un photocatalyseur combiné (CDS / ZNS) -tio2 pour la production électrique via une photoélectrocatalyse.
Les références
- PubChem (2018). Sulfure de zinc. Tiré de: PubChem.NCBI.NLM.NIH.Gouvernement
- Quimiminet (16 janvier 2015). Pigment blanc basé sur le sulfure de zinc. Récupéré de: Quimiminet.com
- Wikipedia (2018). Sulfure de zinc. Pris de: dans.Wikipédia.org
- II-VI UK (2015). Sulfure de zinc (ZN). Pris de: ii-vi.est
- Rob Toreki (30 mars 2015). La structure de zincblende (ZNS). Pris de: ilpi.com
- Chemistry Libretsexts (22 janvier 2017). Blende structure-zinc (ZNS). Tiré de: Chem.Bibliothèque.org
- Reade (2018). Sulfure sulfure / zinc (ZN). Tiré de: Reade.com

