Structure de succinato déshydrogénase, fonction, régulation, maladies
- 1988
- 389
- Prof Noah Collet
SUccinato déshydrogénase (SDH), également connu sous le nom de complexe II de la chaîne de transport d'électrons, il s'agit d'un complexe protéique mitochondrial avec une activité enzymatique qui fonctionne à la fois dans le cycle de Krebs et dans la chaîne de convoyeur électronique (respiration cellulaire).
C'est une enzyme qui est présente dans toutes les cellules aérobies. Dans les eucaryotes, il est un complexe étroitement associé à la membrane mitochondriale interne, tandis que dans les procaryotes, il se trouve dans la membrane plasmique.
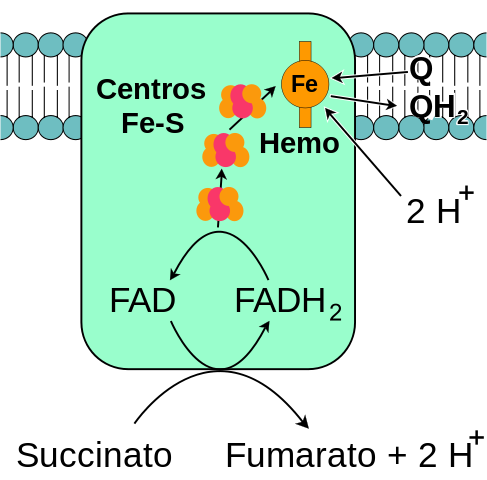 Schéma général du complexe mitochondrial succinate déshydrogénase (Source: Moi-même, basé sur la vectorisation FvasConcellos. / Domaine public, via Wikimedia Commons)
Schéma général du complexe mitochondrial succinate déshydrogénase (Source: Moi-même, basé sur la vectorisation FvasConcellos. / Domaine public, via Wikimedia Commons) La succinate complexe déshydrogénase, découverte vers 1910 et purifiée pour la première fois en 1954 par Singer et Kearney, a été largement étudiée pour plusieurs raisons:
- Il fonctionne à la fois dans le cycle de Krebs (cycle d'acide citrique ou cycle d'acide tricarboxylique) et dans la chaîne de transport d'électrons (catalyse l'oxydation du succinate au fumarate)
- Son activité est régulée par différents activateurs et inhibiteurs et
- C'est un complexe associé à: le fer non lié à un groupe hémo, le soufre labyle et les dyucléotides de Flavina adenina (FAD)
Il est codé par le génome nucléaire et il a été prouvé que les mutations dans les quatre gènes qui codifient chacune de ses sous-unités (A, B, C et D) entraînent diverses images cliniques, c'est-à-dire qu'elles peuvent être assez négatives du point du point de vue de l'intégrité physique des êtres humains.
[TOC]
Structure
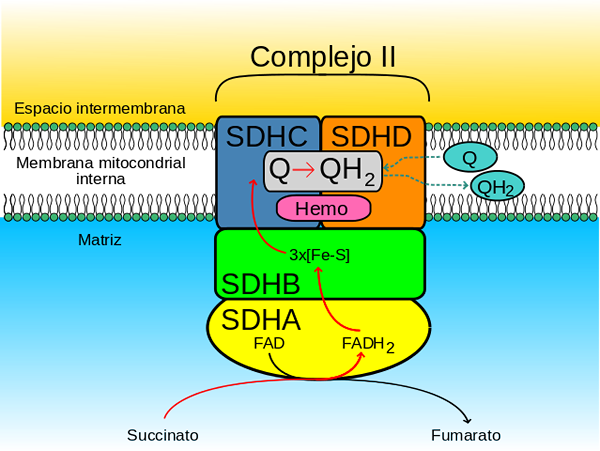
Le complexe enzymatique succinate déshydrogénase est formé par quatre sous-unités (Heterotarámero) codées par le génome nucléaire, c'est donc le seul complexe de phosphorylation oxydative dans la chaîne de convoyeurs électron.
De plus, ce complexe est le seul à ne pas pomper les protons à travers la membrane mitochondriale interne pendant son action catalytique.
Selon des études basées sur le complexe enzymatique des cellules cardiaques porcines, le complexe succinate déshydrogénase se compose de:
- ongle "Tête" Hydrophile qui s'étend de la membrane mitochondriale interne à la matrice mitochondriale et
- ongle "doubler" Hydrophobe qui est intégré dans la membrane mitochondriale interne et qui a un petit segment qui est projeté vers l'espace intermembranaire soluble des mitochondries
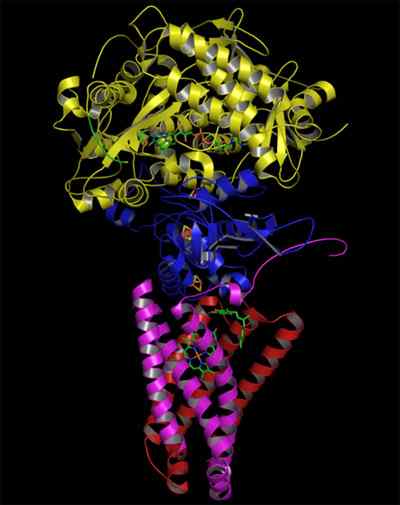
 Structure de la succinate complexe déshydrogénase (Source: Zephyris à la langue anglaise Wikipedia / CC By-SA (http: // CreativeCommons.Org / licences / by-sa / 3.0 /) via Wikimedia Commons)
Structure de la succinate complexe déshydrogénase (Source: Zephyris à la langue anglaise Wikipedia / CC By-SA (http: // CreativeCommons.Org / licences / by-sa / 3.0 /) via Wikimedia Commons) Structure des portions hydrophiles
La tête hydrophile est composée du SDHA (70 kDa) et du SDHB (27 kDa) (SDH1 et SDH2 dans les levures) et cela comprend le centre catalytique du complexe.
Les sous-unités SDHA et SDHB contiennent des cofacteurs redox participant au transfert d'électrons à l'ubiquinone (Coenzyme Q10, une molécule qui transporte les électrons entre les complexes respiratoires I, II et III).
La sous-unité SDHA a un cofacteur FAD (une coenzyme qui participe à des réactions de réduction de l'oxyde) avec sa structure, juste au site de la jonction pour le succinate (le substrat principal de l'enzyme).
La sous-unité SDHB possède 3 centres de fer (FE-S) qui médient le transfert d'électrons à l'ubiquinone. L'un des centres, 2FE-2S, est près du site de la mode de la sous-unité SDHA et des autres (4FE-4S et 3FE-4S) est adjacent au premier.
Peut vous servir: phylogénieIl convient de noter que les études structurelles indiquent que la sous-unité SDHB forme l'interface entre le domaine catalytique hydrophile et le domaine de «l'ancre» à la membrane (hydrophobe) du complexe.
Structure des portions hydrophobes
Le domaine membranal du complexe, comme indiqué, se compose du SDHC (15 kDa) et du SDHD (12-13 kDa) (SDH3 et SDH4 dans les levures), qui sont des protéines membranaires complètes formées, chacune, par 3 hélices transmembranales.
Ce domaine contient une partie hémo b rejoint dans l'interface entre les sous-unités SDHC et SDHD, où chacun des deux ligands d'histidine qui les maintient ensemble.
Dans cette enzyme, deux sites syndicaux pour Ubiquinona ont été détectés: l'une d'une grande affinité et une de faible affinité.
Le site de haute affinité, connu sous le nom QP (P par proximal) Il est face à la matrice mitochondriale et est formé par des résidus d'acides aminés spécifiques situés dans les sous-unités SDHB, SDHC et SDHD.
Le site à faible affinité, également appelé QD (D par distal) C'est, dans la partie de la membrane mitochondriale interne où le complexe est inséré, plus près de l'espace intermembranaire, c'est-à-dire plus loin de la matrice d'organelle.
Ensemble, le complexe total a un poids moléculaire près de 200 kDa et il a été déterminé qu'il a un rapport de 4.2-5.0 nanomoles de flavine par milligramme de protéines et 2 à 4 g de fer pour chaque mol de flavine.
Fonction
Le complexe de succinate enzymatique déshydrogénase remplit une fonction importante dans les mitochondries, car non seulement participe au cycle de Krebs (où elle participe à la dégradation de l'acétyl-CoA), mais aussi dans la chaîne respiratoire, fondamentale pour la production d'énergie ATP ATP -.
En d'autres termes, c'est une enzyme clé pour le métabolisme intermédiaire et la production aérobie de l'ATP.
- Il est responsable de l'oxydation du succinate à fumarate dans le cycle de l'acide citrique
- Il nourrit le complexe III de la chaîne de convoyeurs électron avec les électrons dérivés de l'oxydation du succinate, ce qui aide à réduire l'oxygène et à former l'eau
- Le transport d'électrons génère un gradient électrochimique à travers la membrane mitochondriale interne, qui favorise la synthèse d'ATP
Comme alternative, les électrons peuvent être utilisés pour réduire les molécules d'un «pool» d'Ubiquinonas, produisant les réducteurs nécessaires pour réduire les anions superoxyde qui proviennent de la même chaîne respiratoire ou qui proviennent de sources exogènes.
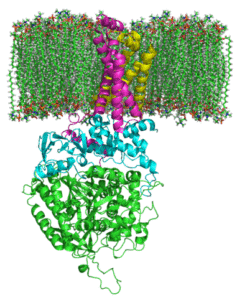
 Complexe de succinate Degidrogenasa (Source: Johnhfst / Domaine public, via Wikimedia Commons)
Complexe de succinate Degidrogenasa (Source: Johnhfst / Domaine public, via Wikimedia Commons) Comment ça agit?
La sous-unité A du complexe (qui est liée de manière covalente au coenzyme de la FAD) rejoint les substrats, le fumarate et le succinate, ainsi que ses régulateurs physiologiques, l'oxalacétate (inhibiteur compétitif) et l'ATP.
L'ATP déplace l'union entre l'oxalacétate et le complexe SDH et, puis, les électrons qui sont "passés" du succinate à la sous-unité SDHA sont transférés aux groupes d'atomes de fer et de soufre présents dans la sous-unité SDHB au moyen de la moelle de coenzyme.
Peut vous servir: myosine: caractéristiques, structure, types et fonctionDe la sous-unité B, ces électrons atteignent les sites Hemo b des sous-unités SDHC et SDHD, d'où ils sont "livrés" à Quinonas Coenzymes à travers leurs sites syndicaux à Quinonas.
L'écoulement électronique du succinate à travers ces transporteurs et même l'accepteur final, qui est de l'oxygène, est couplé à la synthèse de 1.5 molécules d'ATP pour chaque couple électronique par phosphorylation de la chaîne respiratoire.
Défauts d'Inzima
Il a été signalé que des mutations du gène qui code pour la sous-unité A de la succinate déshydrogénase complexe peuvent provoquer des encéphalopathies pendant l'enfance, en attendant les mutations des gènes qui codent pour les sous-unités B, C et D ont été associées à la formation de tumeurs.
Régulation
L'activité de la succinate complexe déshydrogénase peut être régulée par des modifications post-traductionnelles telles que les phosphorylation et la acétylation, Bien que l'inhibition active du site puisse également se produire.
L'acétylation de certains déchets de lysine peut diminuer l'activité de cette enzyme et ce processus est effectué par une enzyme d'acétylase connue sous le nom de SIRT3; La phosphorylation a le même effet sur l'enzyme.
En plus de ces modifications, le complexe SDH est également régulé par les intermédiaires du cycle de Krebs, en particulier le Oxalacétate et le succina. L'oxalacétate est un puissant inhibiteur, tandis que le succinate favorise la dissociation de l'oxalacétate, fonctionnant comme un activateur.
Carence impulcinante déshydrogénase
La déficience succinate déshydrogénase est une anomalie ou un trouble de la chaîne respiratoire mitochondriale. Cette carence est causée par les mutations SDHA (ou SDHAF1), SDHB, SDHC et SDHD.
Différentes enquêtes ont démontré des mutations homozygotes et hétérozygotes dans ces gènes, en particulier le SDHA. Les mutations de ces gènes provoquent des substitutions d'acides aminés dans la protéine (dans l'une des SDHA, B, C ou D), ou à défaut qui codifieront les protéines anormalement courtes.
Par conséquent, les substitutions d'acides aminés et le codage des protéines anormalement court, entraînent des troubles ou des modifications de l'enzyme SDH, ce qui provoque une défaillance de la capacité optimale des mitochondries à produire de l'énergie. C'est ce que les scientifiques appellent un trouble de la chaîne respiratoire mitochondriale.
Ce trouble peut être exprimé dans l'être humain phénotypiquement à bien des égards. Les plus connus sont: une carence ou un manque de développement linguistique, un quadruplex spastique, des contractions involontaires musculaires (dystonie), une faiblesse musculaire et une myocardiopathie, entre autres problèmes connexes.
Certains patients atteints de déficience en succinate déshydrogénase peuvent manifester la maladie de Leight ou le syndrome de Kearns-Saire.
Comment la carence en succinate déshydrogénée est-elle détectée?
Certaines études suggèrent l'utilisation de tests et d'analyses qualitatifs, ainsi que l'analyse biochimique de la chaîne respiratoire quantitative, enzymatique,. D'autres, en revanche, suggèrent l'expansion complète par la réaction en chaîne par polymérase (PCR) des exons des sous-unités à l'étude puis, le séquençage respectif.
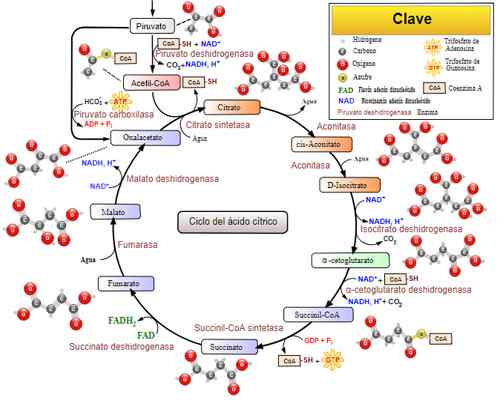 Cycle d'acide tricarboxylique (cycle Krebs). Pris et édité à partir de: Narayanais, Wikiuserpedia, Yassinemrabet, Totobaggins (traduit en espagnol par Alejandro Porto) [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)].
Cycle d'acide tricarboxylique (cycle Krebs). Pris et édité à partir de: Narayanais, Wikiuserpedia, Yassinemrabet, Totobaggins (traduit en espagnol par Alejandro Porto) [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Maladies connexes
Il existe de nombreuses expressions phénotypiques produites par les troubles de la chaîne respiratoire mitochondriale, en raison d'une carence en succinate déshydrogénase. Cependant, lorsqu'il s'agit de syndromes ou de maladies, il est question de ce qui suit.
Peut vous servir: les 8 cycles biogéochimiques les plus importants (description)Syndrome de Leight
Il s'agit d'une maladie neurologique progressive, associée à des mutations du génome nucléaire (en l'occurrence de succinate de déshydrogénase), qui affectent le complexe de pyruvate-dishydrogénase à la voie de phosphorylation oxydative.
Les symptômes apparaissent avant la première année de l'individu, mais dans les cas atypiques, les premiers symptômes à l'adolescence ont été observés.
Parmi les symptômes les plus couramment observés figurent: l'hypotonie avec perte de contrôle céphalique, mouvements involontaires, vomissements récurrents, problèmes respiratoires, incapacité à déplacer les cellules sanguines oculaires, la pyramide et les signes extrapiramidaux entre autres, entre autres,. Les convulsions ne sont pas très courantes.
Il est possible que la maladie puisse être détectée dans des diagnostics prénatals. Un remède ou un traitement spécifique n'est pas connu, mais certains spécialistes suggèrent des traitements avec certaines vitamines ou cofacteurs.
Tumeur de stroma gastro-intestinal (GIST)
Communément appelé GIST, il s'agit d'un type de tumeur gastro-intestinale, qui se développe généralement dans des zones telles que l'estomac ou l'intestin grêle. On pense que la cause de ceux-ci est due à un certain groupe de cellules hautement spécialisées appelées cellules ICC ou cellules interstitielles de Cajal.
D'autres considérations concernant la cause de l'essentiel sont les mutations de certains types de gènes qui, selon certains auteurs, provoquent 90% des tumeurs. Les gènes impliqués sont: kit, gènes pdgfra, succinate déshydrogénase (SDH) - pauvre.
La succinate déshydrogénase (SDH) - pauvre, se produit principalement chez les jeunes femmes, produit des tumeurs d'estomac et avec une fréquence relative produit des métastases dans les ganglions lymphatiques. Un petit pourcentage se produit chez les enfants et dans la plupart des cas, cela est dû au manque d'expression de la sous-unité SDHB.
Syndrome de Kearns-Sayre
Il a été déterminé que certains patients présentant des carences de succinate déshydrogénase peuvent manifester le syndrome de Kearns-Sayre. Cette maladie est liée aux troubles mitochondriaux et se caractérise par l'absence de mouvement de ballons oculaires.
Les autres caractéristiques de cette maladie sont la rétinite pigmentaire, la surdité, la cardiomyopathie et les conditions du système nerveux central. Habituellement, ces symptômes sont observés avant que le patient ait 20 ans. Aucun diagnostic prénatal pour cette condition n'est connu.
Cure non plus pour cette maladie. Le traitement est palliatif, c'est-à-dire qu'il ne fonctionne que pour réduire les effets de la maladie, et non la guérison. D'un autre côté, bien que cela dépend du nombre d'organes affectés et des soins médicaux reçus, l'espérance de vie est relativement normale.
Les références
- Ackrell, b. POUR., Kearney, E. B., & Chanteur, t. P. (1978). [47] succinate de mammifère déshydrogénase. Dans les méthodes en enzymologie (vol. 53, pp. 466-483). Presse universitaire.
- Brère, J. J., Favier, J., Ghouzzi, v. ET., Djoudi, f., Benit, P., Gimenez, un. P., & Rustin, P. (2005). Déficit de succinate déshydrogénase chez l'homme. CMLS Cellular and Molecular Life Sciences, 62 (19-20), 2317-2324.
- Cecchini, G., Schröder, je., Gunalus, R. P., & Maklashina, et. (2002). Succinate déshydrogénase et rédactase fumière d'Escherichia coli. Biochimica et Biophysica Acta (BBA) -Bioenergetics, 1553 (1-2), 140-157.
- Hainefi, et., & Davis, k. POUR. (1971). Succinate déshydrogénase. Toi. Purification, propriétés moléculaires et substructure. Biochimie, 10 (13), 2509-2516.
- Hederstedt, L. POUR. R. S., & Rutberg, L. POUR. R. S. (1981). Succinate déshydrogénase-a revue comparative. Revues microbiologiques, 45 (4), 542.
- Nelson, D. L., Lehninger, un. L., & Cox, M. M. (2008). Principes de lehninger de la biochimie. Macmillan.
- Rutter, J., Winge, D. R., & Schiffman, J. D. (2010). Succinate déshydrogénase-asembly, régulation et rôle dans la désir humain. Mithochondrion, 10 (4), 393-401.
- « Fonctions essentielles des acides gras, importance, nomenclature, exemples
- Les fonctionnalités de la règle T, de sorte qu'elle sert, des exemples »

