Concept de sublimation, processus et exemples
- 3579
- 1035
- Raphaël Charles
La sublimation Il s'agit d'un processus thermodynamique dans lequel un changement d'état endothermique se produit directement d'un solide à un gaz, sans la formation antérieure du liquide. Un exemple exceptionnel de ce processus est celui de la glace sèche; Lorsqu'il est exposé au soleil ou immergé dans un liquide, il passe directement de l'état solide à gazeux.
Le comportement du solide dans des conditions normales est de se réchauffer et de créer une première goutte, où plus de particules solides se dissolvent jusqu'à ce que. Pendant ce temps, en sublimation, on parle d'une "bulle", d'une vapeur progressive sans mouiller la surface qui touche, mais qui déposa immédiatement ou cristallise.
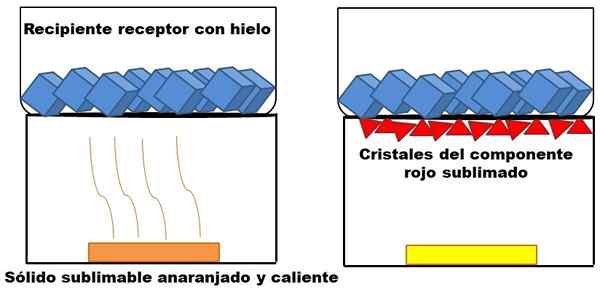
 Exemple de sublimation d'un solide orange hypothétique. Source: Gabriel Bolívar.
Exemple de sublimation d'un solide orange hypothétique. Source: Gabriel Bolívar. Ce qui est décrit dans le paragraphe supérieur est représenté dans l'image supérieure. Supposons un mélange solide orange (à gauche), qui commence à augmenter son énergie en augmentant la température. Le composant rouge sublimal, puis déposé au bas du conteneur de réception, dont la température est plus basse en raison des glaçons dans son contenu.
Les triangles ou cristaux rouges sont déposés grâce à la surface froide de ce récipient (à droite), qui absorbe sa température; Et même s'il n'est pas montré, la taille de ses glaçons doit diminuer en raison de l'absorption de chaleur. Le solide restant a un composant jaune non publié dans des conditions de processus.
[TOC]
Concept de sublimation
Processus
Il a déjà été dit que la sublimation est un changement d'état endothermique, car pour cela, il doit y avoir une absorption de chaleur. Si le solide absorbe la chaleur, son énergie augmentera, donc ses particules vibreront également à des fréquences plus grandes.
Lorsque ces vibrations deviennent très fortes, elles finissent par affecter les interactions intermoléculaires (et non les liaisons covalentes); Et par conséquent, tôt ou tard, les particules prendront plus de distances les unes des autres, jusqu'à ce qu'elles parviennent à couler et à se déplacer plus librement dans les régions de l'espace.
Peut vous servir: règle diagonaleDans certains solides, les vibrations sont si fortes que certaines particules sont "déclenchées" en dehors de la structure au lieu d'agglomérer dans des grappes mobiles qui définissent une goutte. Ces particules s'échappent et intègrent la première "bulle", qui préfère former les premières vapeurs du solide sublimé.
Il est alors parlé non pas d'un point de fusion, mais d'une sublimation. Bien que les deux dépendent de la pression régnante sur le solide, le point de sublimation est plus; Par conséquent, sa température varie considérablement avec les changements de pression (comme c'est le cas avec le point d'ébullition).
De la structure solide au trouble du gaz
En sublimation, il est également dit qu'il y a une augmentation de l'entropie du système. Les états énergétiques des particules vont de leur limite par leurs positions fixes dans la structure solide, pour homogénéiser dans leurs directions capricieuses et chaotiques à l'état gazeux, plus uniformes, où ils acquièrent enfin une énergie cinétique moyenne.
Diagramme de phase et triple point
Le point de sublimation dépend de la pression; Parce que sinon, les particules solides absorberaient la chaleur pour ne pas se faire tirer dans l'espace à l'extérieur du solide, mais pour former des gouttes. Il ne serait pas sublimé, mais fondrait ou fondrait, comme c'est le plus habituel.
Plus la pression externe est grande, moins la sublimation sera probable, car le solide à fondre est obligé.
Mais quels solides sont sublimmables et qui ne? La réponse réside dans vos diagrammes de phases P VS T, comme indiqué ci-dessous:
Peut vous servir: néon: historique, propriétés, structure, risques, utilisations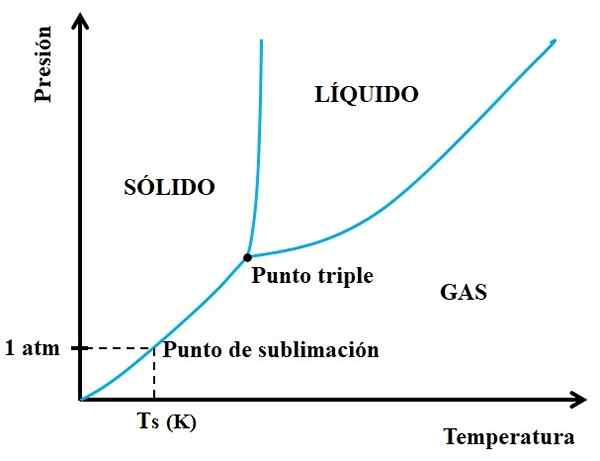 Diagramme de phase pour une substance hypothétique. Source: Gabriel Bolívar.
Diagramme de phase pour une substance hypothétique. Source: Gabriel Bolívar. Vous devez regarder d'abord le point triple et parcourir le tronçon inférieur: celui qui sépare les états solides et gazeux. Notez que dans la région solide, il doit y avoir une diminution de la pression afin que la sublimation se produise (pas nécessairement 1 pression atmosphérique). Un 1 atm, la substance hypothétique sublim sera à une température Ts exprimée en k.
Plus la section ou la courbe de longue durée est longue et longue sous le point triple, plus la capacité du solide à sublim est grande à différentes températures; Mais s'il est bien inférieur à 1 atm, il sera nécessaire avec des écarts élevés pour atteindre la sublimation, de sorte que les pressions sont réduites (0,0001 atm, par exemple).
Conditions
Si le point triple est des milliers de fois plus bas que la pression atmosphérique, le solide n'appliquera jamais ou même appliquera une vie ultra (sans parler de sa sensibilité à se décomposer par l'action de la chaleur).
Si ce n'est pas le cas, les sublimations sont effectuées au moyen de modérément et soumettant le solide à l'aspirateur afin que leurs particules s'échappent plus facilement, sans avoir besoin d'absorber autant de chaleur.
La sublimation devient très importante lorsqu'elles sont particulièrement solides avec une pression de vapeur élevée; c'est-à-dire la pression à l'intérieur, la réflexion de l'efficacité de ses interactions. Plus sa pression de vapeur est grande, plus elle est odorante, et aussi plus sublimable.
Exemples
Purification solide
L'image du solide orange et de son composant rougeâtre sublimmable est un exemple de ce que la sublimation représente en ce qui concerne la purification solide. Les triangles rouges peuvent être relevés autant de fois que nécessaire jusqu'à ce que la grande pureté soit garantie.
Peut vous servir: spatule de laboratoireCette technique est principalement utilisée avec des solides parfumés. Par exemple: camphre, caféine, benzoine et mentol.
Entre autres solides qui peuvent sous-informer la sublimation que nous avons: iode, glace (à grandes altitudes), théobromine (chocolat), saccharine, morphine et autres médicaments, bases d'azote et anthracène.
Synthèse des cristaux
De retour aux triangles rouges, la sublimation offre une alternative à la cristallisation conventionnelle; Les cristaux ne seront plus synthétisés à partir d'une solution, mais par des moyens.
Disons que s'ils ont des carrés rouges, la croissance des cristaux maintiendra cette géométrie et ne devrait pas devenir triangulaire. Les carrés rouges grandiront progressivement au fur et à mesure que la sublimation aura lieu. Cependant, c'est un complexe opérationnel et moléculairement complexe, dans lequel de nombreuses variables impliquées sont observées.
Les exemples de cristaux synthétisés via la sublimation sont: le carbure de silicium (sic), le graphite, l'arsenic, le sélénium, le phosphore, le nitruro en aluminium (aln), le sulfure de cadmium (CDS), le zinc séléniuro (znse), le mercure iodure (HGI)2), graphène, entre autres.
Notez qu'ils sont vraiment deux phénomènes compérés: sublimation progressive et dépôt (ou sublimation inverse); La vapeur émigre des régions ou surfaces solides aux plus froides, pour enfin déposer sous forme de cristaux.
Thèmes d'intérêt
Exemples de sublimation.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2019). Sublimation (transition de phase). Récupéré de: dans.Wikipédia.org
- Jones, Andrew Zimmerman. (27 janvier 2019). Sublimation. Récupéré de: Thoughtco.com
- Sheila Morrissey. (2019). Qu'est-ce que la sublimation en chimie? - Définition, processus et examens. Étude. Récupéré de: étudier.com
- Elsevier B.V. (2019). Méthode de sublimation. ScienceDirect. Récupéré de: ScienceDirect.com
- « Caractéristiques des sous-caduiso-forêts tropicales, flore, faune
- Propriétés intégrales intimes, applications, calcul (exemples) »

