Solutions chimiques
- 1173
- 198
- Mlle Ambre Dumont
Nous expliquons quelles solutions chimiques, leurs caractéristiques, les types qui existent et donnent plusieurs exemples
 Un produit chimique est un mélange homogène entre deux substances
Un produit chimique est un mélange homogène entre deux substances Quelles sont les solutions chimiques?
Le Solutions chimiques Ce sont des mélanges homogènes entre un solvant et un ou plusieurs solutés. Les solutions les plus simples sont formées par un seul soluté et un solvant, comme lorsque nous dissolvons le sucre dans l'eau, mais il existe des solutions qui peuvent devenir très complexes avec des centaines de solutés.
Les solutions les plus courantes sont à l'état liquide, et dans la plupart des cas, le solvant est de l'eau. Pour cette raison, l'eau est généralement appelée "le solvant universel". Mais les solutions ne se limitent pas aux liquides, car il existe des solutions à l'état gazeux et solide.
Le soluté peut également être trouvé dans différents états. Par exemple, des solutions liquides avec des solutés solides (comme le sel), des fluides (comme l'alcool) ou des gaz gazeux (comme le gaz carbonique dans les boissons gazeuses) peuvent avoir des solutions solides).
Comment reconnaître le soluté et le solvant?
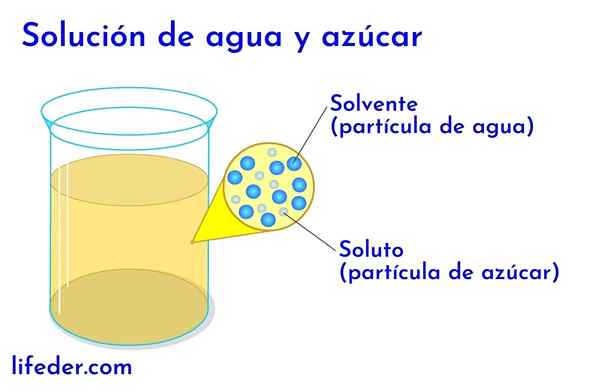
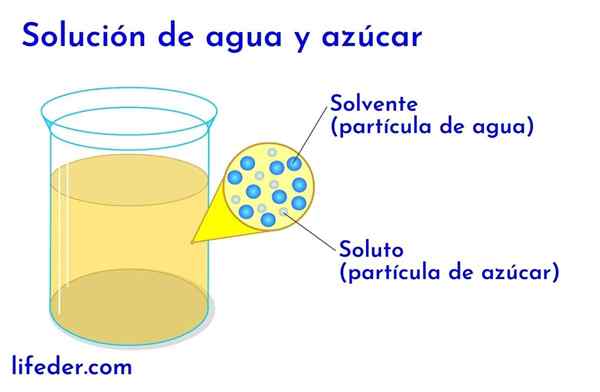 Soluté et solvant dans l'eau avec du sucre
Soluté et solvant dans l'eau avec du sucre Dans n'importe quelle solution dans laquelle il y a de l'eau, il est considéré comme le solvant. Dans tous les autres cas, le solvant correspond au composant qui est en plus grande quantité ou plus proportionnellement et est presque toujours un liquide. Les autres composants présents dans la solution sont considérés comme des solutés.
Regardons deux exemples:
- Dans une solution d'eau et de sucre, l'eau est le solvant et le sucre le soluté.
- L'alcool isopropylique que nous achetons dans la pharmacie est une solution formée par l'eau et l'alcool. Dans cette solution, le solvant est de l'eau malgré une proportion plus petite que l'alcool.
Caractéristiques et propriétés des solutions chimiques
Ce sont des mélanges homogènes
Les solutions sont des mélanges dans lesquels le soluté de solvant ne peut pas être distingué, ni à l'œil nu ni à l'utilisation d'une loupe ou d'un microscope.
Ils ont une composition uniforme
Cela signifie que toute partie d'une solution aura toujours les mêmes composants (soluté et solvant) à la même concentration.
Peut vous servir: Cadmium (CD): Historique, propriétés, structure, utilisationsIls sont caractérisés par leur concentration
La concentration est l'une des caractéristiques les plus importantes d'une solution, car elle détermine bon nombre de ses propriétés.
Ils sont translucides (transparents)
Les solutions liquides doivent être translucides, c'est-à-dire que la lumière doit être capable de les traverser sans se disperser.
Ils sont stables
Une solution dans laquelle le soluté et le solvant ne réagissent pas les uns aux autres seront stables indéfiniment. Cela signifie qu'il ne subira aucun changement au fil du temps, tant que sa composition reste constante (le solvant n'évapore pas, par exemple).
Ses propriétés physiques et chimiques sont différentes de celles du solvant
Les propriétés physiques et chimiques du solvant changent lors du mélange avec le soluté. Par exemple, les solutions ont un point d'ébullition plus élevé, un point de fusion plus bas et ont également une pression osmotique élevée par rapport au solvant pur.
Ils peuvent être séparés par certains processus physiques et chimiques
Les solutions ne peuvent pas être séparées par filtration, centrifugation ou décantation. Ils ne peuvent être séparés que par des méthodes physiques ou chimiques telles que la cristallisation, la distillation, l'évaporation, l'osmose inverse et la chromatographie, entre autres.
 Instruments de distillation
Instruments de distillation Types de solutions chimiques
Les solutions chimiques peuvent être classées en fonction de leur concentration, selon leur condition physique et selon la nature du solvant:
Selon votre concentration
- Solutions insaturées: Ce sont ceux dans lesquels le soluté n'a pas encore atteint sa concentration maximale dans le solvant. Pour cette raison, plus de soluté peut être dissous pour préparer une solution plus concentrée.
- Solutions saturées: Ce sont des solutions dans lesquelles le solvant ne peut plus dissoudre plus de soluté. Dans ces cas, il y a toujours une partie du soluté sans dissoudre. Par exemple, si nous ajoutons beaucoup de sel à un verre avec de l'eau, une partie de ce sel ne se dissout pas et restera au fond du verre.
- Solutions superaturées: Ce sont des solutions dans lesquelles il y a plus de soluté dissous que le solvant ne l'admet. Cela peut être réalisé en chauffant une solution saturée pour dissoudre encore plus de soluté, puis en laissant lentement refroidir jusqu'à la température initiale. Ces solutions sont instables, car toute perturbation telle que les vibrations ou une petite particule de poussière à la surface peut provoquer la séparation de l'excès de soluté.
Selon votre condition physique
- Solutions liquides: Ils sont les plus courants. Dans ce type de solutions, le solvant est un liquide (comme l'eau, l'alcool, l'huile, etc.) Mais le soluté peut être trouvé dans n'importe quel état (solide, liquide ou gaz). Quelques exemples de solutions liquides sont l'eau salée, le vin et les boissons gazeuses.
- Solutions solides: Dans ces cas, le solvant et le soluté sont à l'état solide. Les exemples les plus courants de ce type de solutions sont les alliages métalliques tels que le bronze, l'acier et le laiton, mais il existe également d'autres exemples tels que le verre.
- Solutions gazeuses: Comme son nom l'indique, ce sont des mélanges homogènes dans lesquels tous les composants sont dans un état gazeux.
Selon le solvant
- Solutions aqueuses: Si dans une solution, le solvant est de l'eau, alors il est dit que c'est une solution aqueuse. Ce sont les solutions les plus courantes que l'on trouve dans la vie quotidienne.
- Solutions alcoolisées: Le solvant le plus courant, après l'eau, est l'alcool. Parmi les alcools les plus courants figurent le méthanol, l'éthanol et l'alcool isopropylique.
- Solutions dans d'autres solvants organiques: Il existe de nombreux autres composés organiques qui sont utilisés comme solvants. Il s'agit notamment de certains alcanes, de la plupart des éthers, des cétones liquides et d'autres.
Exemples de solutions chimiques
Limonade
C'est une solution aqueuse formée par l'eau sous forme de solvant et de jus de citron et de sucre comme des solutés.
Eau de mer
L'eau de mer ou l'eau salée est une solution aqueuse composée d'eau et un mélange de sels. Parmi ces sels, celui qui est le plus de proportion est le chlorure de sodium (NaCl) connu sous le nom de sel de table commune.
Peut vous servir: oxyde de mercure (hg2o)Sirop concentré
Ceci est une solution aqueuse presque saturée d'eau de sucre.
Eau gazeuse
L'eau gazeuse, également connue sous le nom de soude, est une solution aqueuse de dioxyde de carbone gazeux (CO2) Dans l'eau.
Air
L'air est une solution gazeuse dans laquelle l'azote peut être considéré comme un solvant et de l'oxygène et d'autres gaz comme des solutés.
Beurre clarifié
En faisant fondre le beurre et en retirer toute la mousse, une solution jaune transparente appelée beurre clarifié est obtenue. Ceci est une solution dans laquelle le solvant et les solutés sont gras.
Verre coloré
Le verre de couleur sont des solutions à semi-conducteurs, dans lesquelles le solvant est de la silice fondue et les solutés sont d'autres minéraux qui fournissent au verre sa couleur caractéristique.
Café
Il s'agit d'une solution aqueuse complexe qui contient de nombreux solutés (dont la caféine) qui donnent à la boisson son arôme et sa saveur caractéristiques.
L'acier
L'acier est un alliage ou une solution solide formée par du fer métallique et du carbone de graphite.
Plasma sanguin
Le plasma sanguin est une solution qui est obtenue après avoir centrifugé le sang pour éliminer toutes les cellules et autres solides en suspension. Il s'agit d'une solution aqueuse assez concentrée qui contient des centaines de solutés, notamment des glucides, des acides aminés, des protéines solubles et des électrolytes, entre autres.
Les références
- Chang, R. et Goldsby, k. (2014). Chimie. 11e édition. New York: McGraw-Hill Education.
- Solution (25 janvier 2021). À Wikipedia.org.
- Brun, t. L., Lemay, e. (2018). Chimie: la science centrale. 14e édition. Pearson.
- Krestonosich, S., et autres. (1992). Solutions. Éditorial Miró.
- Vidal, J. POUR. (Éditeur) (1997). Mentor interactif - Encyclopédie thématique des étudiants. Ocean Editorial. Barcelone.

