Composition de solutions cristalloïdes, types et exemples
- 1232
- 253
- Prof Noah Collet
Le Solutions cristalloïdes Ce sont ceux formés par la dissolution d'un électrolyte et d'autres petites molécules solubles dans l'eau, utilisées dans des procédures de routine cliniques telles que l'ajustement du volume de fluide du système circulatoire. En termes chimiques simples: ces solutions ne sont rien de plus que des solutions miniers aqueuses et diluées.
Les solutions cristalloïdes jouent un rôle important dans les thérapies cliniques telles que les fluides d'infusions intraveineux pour les cas d'hémorragie, de déshydratation, d'hypovolémie et d'infections. Habituellement, sa concentration saline est isotonique, ce qui signifie que le nombre de ses ions dissous est comparable à celui du plasma sanguin.
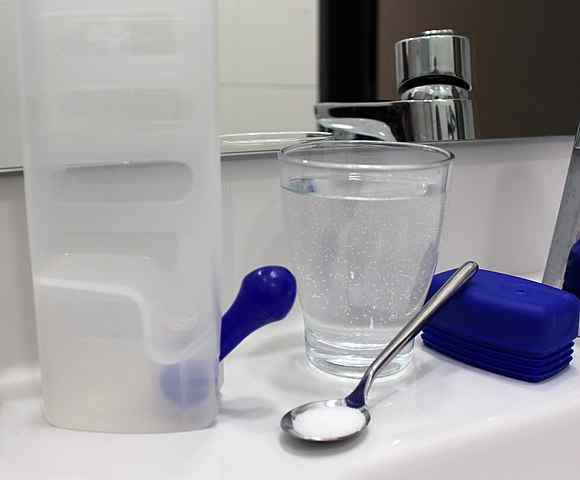
 Une solution cristalloïde peut être préparée simplement en dissolvant le sel et d'autres solutés dans l'eau à une concentration modérée. Source: Rillke / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Une solution cristalloïde peut être préparée simplement en dissolvant le sel et d'autres solutés dans l'eau à une concentration modérée. Source: Rillke / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0) Les solutions cristalloïdes ne provoquent donc pas de modifications osmotiques, mais fournissent un volume de liquide approprié afin que le sang continue d'irriguer par le système circulatoire. De cette façon, il est obtenu que le cœur pompe le sang dilué et puisse fournir de l'oxygène aux tissus.
Un exemple de solution cristalloïde est la solution saline normale, qui contient du NaCl à une concentration de 0,9%. Cependant, selon le cas clinique, d'autres solutions peuvent être choisies, avec des composants, des concentrations et des types de tonicité différents.
[TOC]
Composition de solutions cristalloïdes
Toutes les solutions cristalloïdes sont basées sur des micro-organismes stérilisés ou sans micro-organismes, c'est donc son solvant préféré. Sinon, ils ne pouvaient pas s'intégrer sainement dans notre corps et provoquer une réaction indésirable. En tant que solution ou solution qu'elle est, elle a également des solutés, qui sont essentiellement des sels minéraux ou des électrolytes forts.
Les ventes peuvent être plusieurs, tant qu'elles contribuent à des concentrations modérées les ions na+, CA2+, K+ et cl-. En plus des sels inorganiques, ils peuvent également avoir des solutés organiques très solubles dans l'eau comme les acétates, les gluconates et les lactates. De plus, certaines de ces solutions contiennent du glucose (dextrose).
Peut vous servir: hydroxyapatiteLes concentrations de ces sels ou de ces solutés sont très variées et sont exprimées soit en pourcentages, milligramme par les décilitres (mg / dl), les molarités ou les osmolarités. Le choix de l'un ou de l'autre dépendra des critères cliniques.
Gars
Il a été dit au début que les solutions cristalloïdes sont fréquemment utilisées pour fournir un volume de liquide au système circulatoire. Dans le processus, en fonction de sa tonique, le plasma sanguin souffre ou des changements nonosmotiques, qui favorisent ou favorisent certains états souhaités chez le patient.
Ainsi, la seule chose qui distingue une solution cristalloïde d'une autre n'est pas la nature chimique de son soluté, mais sa tonique; c'est-à-dire s'il s'agit d'une solution hypertonique, isotonique ou hypotonique.
Hypertonique
Une solution cristalloïde hypertonique est celle dont la concentration saline est supérieure à celle trouvée dans le plasma sanguin. Par conséquent, l'eau migre de l'intérieur des cellules vers le plasma qui a augmenté sa tonicité en raison de la présence de la solution cristalloïde hypertonique. Un exemple de ce type de solution est celui de 3% de NaCl, notamment plus concentré que la solution saline normale à 0,9%.
Ces solutions sont contre-indiquées pour la plupart des cas cliniques, à l'exception de ceux qui présentent des séquelles neurologiques.
Isotonique
Une solution cristalloïde isotonique est celle dont la concentration saline est comparable ou identique à celle du plasma sanguin et de celle de l'intérieur cellulaire. Par conséquent, il n'y a pas d'échange d'eau entre les deux supports. Un exemple de ce type de solution est de 0,9% de NaCl, déjà mentionné ci-dessus.
Hypotonique
Et enfin, une solution de cristalloïde hypotonique est que dont la concentration saline est inférieure à celle du plasma sanguin et du compartiment ou de l'espace intracellulaire. Cette fois, l'eau se déplace dans l'intérieur de la cellule jusqu'à atteindre l'équilibre. Un exemple de ce type de solution est de 0,45% de NaCl.
Il peut vous servir: métaux alcalinotherresComme pour les solutions cristalloïdes hypertoniques, l'hypotonique est contre-indiquée pour la plupart des cas cliniques, en particulier pour ceux où il existe un risque d'œdème cérébral.
Exemples de solutions cristalloïdes
Quelques exemples de solutions cristalloïdes seront mentionnés et décrits ci-dessous. La différence entre l'une et l'autre résidera dans l'identité de ses électrolytes ou des sels dissous.
Solution saline normale
La solution saline normale a une composition de NaCl à 0,9%, est isotonique et est également la solution cristalloïde la plus récurrente, car elle sert à traiter les infinités de cas de déshydratation courants; comme ceux causés par la diarrhée, le choc, les vomissements, les saignements, entre autres. Cependant, l'utilisation chez les patients avec des problèmes rénaux ou cardiaques est évité.
Solution de lactate
Également connu sous le nom de solution Ringer ou Hartmann (bien qu'ils diffèrent légèrement par leurs concentrations ioniques), il est composé d'un mélange de chlorure de sodium, de lactate de sodium, de chlorure de calcium et de chlorure de potassium.
Sa composition saline est celle qui ressemble à celle du plasma sanguin, donc c'est un type isotonique. Il est utilisé comme fluide ou liquide expert pour les cas de brûlures, traumatismes, déséquilibre électrolytique, acidose métabolique. Cependant, il est contre-indiqué pour les patients souffrant d'hypercalcémie.
Le lactate est métabolisé dans notre corps et finit par se transformer en bicarbonate. Cette solution peut également contenir un anion de gluconate, ainsi que certaines quantités de magnésium, mg2+.
Solution de glucose
Également connu sous le nom de solution cristalloïde de dextrose, il est disponible en deux concentrations: 5 et 10% (D5 ou D10, respectivement). Ceci est initialement hypotonique, mais il est transformé en isotonique une fois le glucose absorbé, fournissant de l'eau aux reins. Bien qu'il fournit une quantité importante de calories, il est contre-indiqué pour les patients souffrant d'hyperglycémie.
Peut vous servir: acide élagique: structure, propriétés, obtenir, emplacement, utiliserContrairement à d'autres solutions cristalloïdes, ce sont doux. Les concentrations les plus sucrées ont plus de 10% (d20, d30, d50, etc.), Et ils sont destinés aux patients atteints d'œdème pulmonaire et cérébral. D'un autre côté, ils réduisent le catabolisme des protéines, protègent le foie et aident à lutter contre les effondrements circulatoires.
Solutions salines hypertoniques et hypotoniques
Des solutions salines hypertoniques (3 et 5% de NaCl) sont utilisées pour fournir du liquide aux patients en feu, induire une hyperosmolarité et soulager les insuffisances rénales. En revanche, des solutions salines hypotoniques (0,45% de NaCl ou des concentrations inférieures), contrôlent l'hypernatrémie et sont contre-indiquées pour les patients en feu.
Par conséquent, l'un fournit les effets contraires à l'autre; Lorsque la solution hypertonique est indispensable, l'hypotonique est désapprouvée, et vice versa.
Le mécanisme derrière toutes les solutions cristalloïdes est basé sur l'équilibre osmotique et hydrique entre les fluides intra et extracellulaires.
Les références
- Lewis Sr et al. (3 août 2018). Colloïdes ou cristalloïdes pour le remplacement des fluides chez les personnes critiques. La collaboration Cochrane. Récupéré de: Cochrane.org
- Epstein Em, Waseem M. (29 novembre 2019). Fluides cristalloïdes. Dans: StatPearls. Treasure Island (FL): StatPearls Publishing 2020 -. Récupéré de: NCBI.NLM.NIH.Gouvernement
- Wikipédia. (2020). Expanseur de volume. Récupéré de: dans.Wikipédia.org
- Elsevier B.V. (2020). Cristalloïde. ScienceDirect. Récupéré de: ScienceDirect.com
- Sheila Bouie. (2020). Cristalloïdes: définition et exemple. Étude. Récupéré de: étudier.com
- « Les 20 légendes et mythes vénézuéliens les plus populaires
- Types de cartes et leurs caractéristiques »

