Série spectrale
- 1217
- 183
- Lucas Schneider
Le Série spectrale Ils se composent d'un ensemble de lignes colorées sur un fond sombre, ou des rayures vives séparées par des zones sombres qui émettent la lumière de toutes sortes de substances.
Ces lignes sont visualisées à l'aide d'un spectromètre, un appareil qui se compose d'un prisme ou d'un rack finement divisé, capable de séparer les différents composants de la lumière.
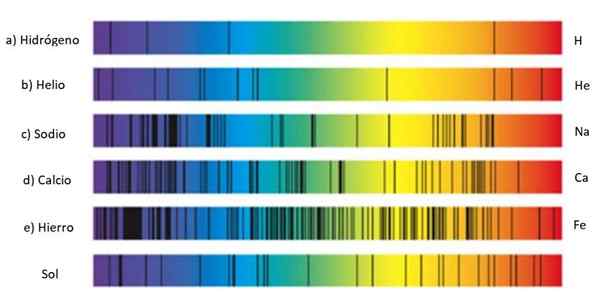
 Spectres d'absorption de différentes substances et du soleil. Source: Wikmedia Commons.
Spectres d'absorption de différentes substances et du soleil. Source: Wikmedia Commons. Ces ensembles de lignes sont appelés spectre Et chaque substance a un spectre caracatériste, une sorte d'empreinte digitale qui sert à identifier sa présence dans la lumière qui vient d'un objet. En effet, chaque atome a sa propre configuration d'électrons et autorisé les niveaux d'énergie.
C'est pourquoi trouver les lignes spectrales est une technique largement utilisée par les astronomes pour découvrir la composition des étoiles à travers la lumière qu'ils émettent. En fait, tout ce que les astronomes savent sur les étoiles proviennent de leurs spectres, que ce soit des émissions ou de l'absorption.
L'origine des spectres
La présence de spectres est due à une configuration atomique. En effet, les électrons restent autour du noyau dans les régions appelées Orbitales, situé à certaines distances discrètes de lui.
Par exemple dans l'hydrogène, l'élément le plus simple, les radios orbitales sont données par 0.053 ∙ n2 Nanomètres, où n = 1, 2, 3, 4, .. . Les valeurs intermédiaires ne sont pas autorisées entre eux, il est donc dit que les orbitales sont quantifié. L'état énergétique de chaque orbite est également quantifié.
De telles restrictions font que les électrons se comportent en même temps que les particules et aussi comme des vagues, tout comme la lumière. Cependant, les électrons peuvent passer d'une orbitale à l'autre, modifiant l'état énergétique de l'atome.
Absorption et émission d'énergie électromagnétique
Par exemple, si un électron passe d'une orbitale plus interne, avec moins d'énergie, à un autre plus externe et plus énergique, il est nécessaire d'acquérir l'énergie électromagnétique nécessaire, qui est stockée dans l'atome. Ce processus est appelé absorption.
D'un autre côté, si l'électron passe d'une plus d'orbitale externe à plus interne, dans la transition, un photon est émis, sous forme légère, qui est l'énergie correspondant à la différence d'énergie entre les orbitales. La longueur d'onde correspond à cette différence et est donnée par:
Peut vous servir: Nébuleuse Orion: origine, emplacement, caractéristiques et données
- E est l'énergie
- λ est la longueur d'onde
- H est la constante de Planck
- C est la vitesse de la lumière
Types de spectres
Il existe à la fois des spectres d'absorption et d'émission, qui dépend de certains paramètres de l'objet ou de la substance, tels que la densité et la température. Le spectre d'un gaz faible est différent de celui d'un solide à haute température.
Spectre continu
Certaines sources émettent des spectres dont les lignes colorées changent doucement et contiennent toutes les couleurs. C'est ce qu'on appelle un spectre continu, par exemple celui qui produit le filament d'une ampoule à incandescence.
Spectre d'émission
C'est celui qui émet certaines substances chaudes et se compose de quelques lignes d'une certaine longueur d'onde.
Ce type de spectre est produit par des gaz faibles et chauds tels que ceux qui remplissent les tubes fluorescents. Boreal Aurora est un autre exemple d'émission qui se produit dans les gaz de la haute atmosphère de la Terre. Ils produisent également des spectres d'émission certains nuages de gaz interstellaires.
Spectre d'absorption
Ce spectre est ce qui est reçu lorsque la lumière d'un objet dense et très chaud se passe par un gaz plus froid. Il y a presque toutes les couleurs observées, mais certains semblent diminués et certaines rayures sombres surviennent dans ces longueurs d'onde qui sont absorbées par les atomes ou les molécules de gaz.
Lois de la spectroscopie de Kirchoff
Les lois de la spectroscopie de Kirchoff indiquent dans quelles conditions les différents spectres décrits ci-dessus sont formés:
- Spectres continus: ils sont émis par n'importe quel objet à haute pression et température.
- Les spectres d'émission: ils sont produits par une basse pression à basse pression, qui émet bien des longueurs d'onde définies, correspondant aux transitions électroniques correspondant à chaque élément qui constitue le gaz.
- Spectres d'absorption: sont produits par des gaz à basse température situés près des polices de rayonnement continu. Les atomes de gaz ou les molécules absorbent uniquement certaines longueurs d'onde.
Le spectre d'émission d'hydrogène
Le spectre d'émission d'hydrogène est particulièrement important, car c'est l'élément le plus abondant dans l'univers et contient beaucoup d'informations importantes sur les étoiles et la voie lactée.
Des lignes de spectre d'hydrogène ont été découvertes par divers chercheurs et chacun est nommé.
Balmer Series
L'hydrogène émet diverses lignes dans le spectre visible: lorsque l'électron diminue de l'orbital 3 à l'orbital 2 émet une lumière rouge, dont la longueur d'onde est 656.6 nm, et s'il se désintègre de l'orbital 4 à 2, il émet 486 lumière bleue.1 nm.
 Spectre d'émission d'hydrogène, montrant les lignes correspondant à la lumière visible et à deux lignes ultraviolets à gauche. Source: Wikmedia Commons.
Spectre d'émission d'hydrogène, montrant les lignes correspondant à la lumière visible et à deux lignes ultraviolets à gauche. Source: Wikmedia Commons. En 1885 (avant que Bohr ne proposait sa théorie), le mathématicien et professeur suisse Johann Balmer (1825-1898) trouvé par Tanteo une formule pour déterminer les longueurs d'onde λ de ces lignes:
Où:
- R est la constante de Rydberg: 1.097 × 107 m-1
- N = 3, 4, 5 .. ., c'est-à-dire n ≥ 3 (entier).
Par exemple, pour n = 3 dans l'équation de Balmer:
Correspondant à la ligne rouge à droite, illustré dans la figure ci-dessus. La découverte de la série Balmer a amené d'autres scientifiques à rechercher des lignes dans le reste du spectre d'hydrogène et d'autres gaz.
Série Lyman
Notez que le spectre d'hydrogène illustré sur la figure contient certaines lignes en ultraviolet, les deux de l'extrême gauche, dont les longueurs d'onde sont 397.0 nm et 388.9. nm.
En effet, ces lignes dans Ultraviolet correspondent à la série So-appelée Lyman, découverte en 1906 par le physicien Theodore Lyman. Sa formule est:
Peut vous servir: BTU (unité thermique): équivalences, utilisations, exemples)
Série Paschen
La série Paschen a été découverte par le physicien allemand Friederich Paschen en 1908 et est valable pour n ≥ 4, c'est-à-dire: n = 4, 5, 6 ..
Les lignes paschen se trouvent dans la région infrarouge proche et le niveau final est n = 3, c'est-à-dire que leurs valeurs se produisent lorsque l'électron diminue des niveaux supérieurs à n = 3. Comme la série Lyman est dans l'ultraviolet, il est conclu que la série Balmer est entre Lyman et Paschen.
Série Brackett
Cette série découverte en 1922 par Frederick Brackett, un physicien américain, est situé dans l'infrarouge lointain et se compose des lignes spectrales correspondant aux transitions d'hydrogène qui commencent à n = 5 et continuent:
Série PFUND
La série PFUND a été trouvée en 1924 par le physicien américain August Hermann Pfund et fait référence aux transitions qui commencent à n = 5, dans le groupe infrarouge lointain:
) Les références
Les références
- Arny, t. 2017. Explorations: une introduction à l'astronomie. 8e. Élégant. McGraw Hill.
- Bauer, w. 2011. Physique pour l'ingénierie et les sciences. 2ieme volume. Mc Graw Hill.
- Chang, R. 2013. Chimie. 11va. Édition. Mc Graw Hill Education.
- Sears, Zemansky. 2016. Physique universitaire avec physique moderne. 14e. Élégant. 2ieme volume. Pearson.
- Windows ouverts à l'univers. Les différents types de spectres. Récupéré de: Media4.OSPPM.frousser.


)
m^-1=656.3&space;\:&space;nm)
)
)