Le salicylate de méthyle
- 1076
- 117
- Mlle Ambre Dumont
Qu'est-ce que le salicylate de méthyle?
Il le salicylate de méthyle C'est un produit chimique, de nature organique, considéré comme le composé avec une plus grande toxicité parmi les salicylates connus, malgré son odeur incolore et agréable avec une légère touche sucrée. Cette espèce est mieux connue sous le nom de l'huile de Gaulteria. Sa formule est c8H8SOIT3.
Il est dans un état liquide dans des conditions de température et de pression standard (25 ° C et 1 atm), constituant un ester organique qui provient naturellement d'une grande variété de plantes. De l'observation et de l'étude de sa production dans la nature, il a été possible de procéder à la synthèse du salicylate de méthyle.
Cette synthèse a été réalisée au moyen d'une réaction chimique entre l'ester de l'acide salicylique et sa combinaison avec le méthanol. De cette façon, ce composé fait partie du sage, du vin blanc et des fruits tels que la prune et la pomme, entre autres trouvés naturellement.
Synthétique, le salicylate de méthyle est utilisé dans la production d'agents aromatisants, ainsi que dans certains repas et boissons.
Structure chimique
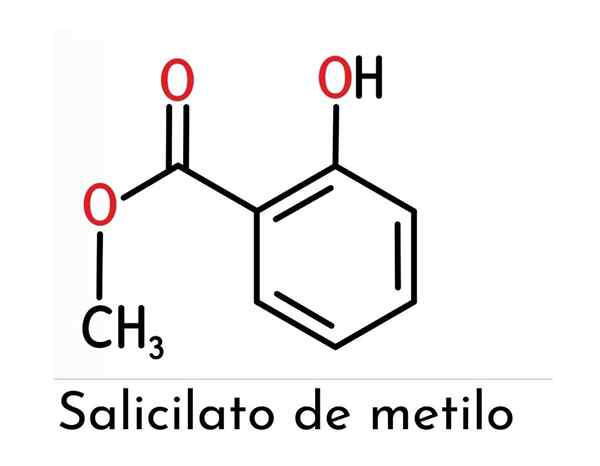
La structure chimique du salicylate de méthyle est constituée par deux groupes fonctionnels principaux (un ester et un phénol attaché à cela), comme le montre l'image supérieure.
Il est observé qu'il est constitué par un anneau benhernique (qui représente une influence directe sur la réactivité et la stabilité du composé), de l'acide salicylique à partir de laquelle il est dérivé.
Pour les nommer séparément, on peut dire qu'ils sont unis en position ortho (1.2) un groupe hydroxyle et un ester méthylique à l'anneau susmentionné.
Peut vous servir: alcool tertiaire: structure, propriétés, exemplesAinsi, comme le groupe OH est lié à l'anneau de benzène, un phénol est formé, mais le groupe qui a la plus grande «hiérarchie» dans cette molécule est l'ester, donnant une structure particulière à ce composé et, par conséquent, des caractéristiques assez spécifiques.
Ainsi, son nom chimique est présenté comme le 2-hydroxybenzoate de méthyle, accordé par l'IUPAC bien que moins fréquemment utilisé lors de la référence à ce composé.
Propriétés de le salicylate de méthyle
- C'est une espèce chimique qui appartient au groupe de salicylates, qui sont des produits d'origine naturelle du métabolisme de certains organismes végétaux.
- Il est de la connaissance des propriétés thérapeutiques des salicylates dans les traitements médicaux.
- Ce composé est présent dans certaines boissons telles que le vin blanc, le thé, la sauge et certains fruits tels que la papaye ou la cerise.
- Il se trouve naturellement dans les feuilles d'un grand nombre de plantes, en particulier dans certaines familles.
- Il appartient au groupe d'esters organiques qui peuvent être synthétisés en laboratoire.
- Il est obtenu à l'état liquide, dont la densité est d'environ 1 174 g / ml dans des conditions de pression et de température standard (1 atm et 25 ° C).
- Il forme une phase liquide incolore, jaunâtre ou rougeâtre, considérée comme soluble dans l'eau (qui est un solvant inorganique) et dans d'autres solvants organiques.
- Son point d'ébullition est d'environ 222 ° C, manifestant sa décomposition thermique autour de 340 à 350 ° C.
- Il présente plusieurs applications, allant de l'agent aromatisant dans l'industrie des bonbons aux analgésiques et à d'autres produits de l'industrie pharmaceutique.
Peut vous servir: Azid de sodium (NAN3): structure, propriétés, utilisations, risques- Sa formule moléculaire est représentée comme c8H8SOIT3 Et il a une masse molaire de 152,15 g / mol.
Utilisations / applications
En raison de ses caractéristiques structurelles, étant un ester méthylique de l'acide salicylique, le salicylate de méthyle a un grand nombre d'utilisations dans différentes zones.
L'une des principales utilisations (et la plus connues) de cette substance est celle de l'agent aromatisant dans différents produits: de l'industrie cosmétique comme parfum pour l'industrie alimentaire comme arôme dans les bonbons (caoutchouc à mastication, bonbons, crème glacée, entre autres).
Il est également utilisé dans l'industrie cosmétique comme agent de chauffage et pour les massages musculaires dans les applications sportives. Dans ce dernier cas, il agit comme un rubans; c'est-à-dire qu'il provoque la rougeur de surface de la peau et les membranes de nature muqueuse en entrant en contact avec ces.
De la même manière, il est utilisé dans la crème pour une utilisation topique, pour ses propriétés analgésiques et anti-inflammatoires dans des traitements pour des conditions rhumatismales.
Une autre de ses applications comprend son utilisation liquide dans les séances d'aromathérapie, en raison de ses caractéristiques d'huile essentielle.
En plus de son utilisation en tant qu'agent de protection contre le rayonnement ultraviolet dans les écrans solaires, ses propriétés devant la lumière pour les applications technologiques sont étudiées, telles que la production de rayons laser ou la création d'espèces sensibles pour stocker des informations au sein des molécules.
Synthèse de le salicylate de méthyle
Premièrement, il convient de mentionner que le salicylate de méthyle peut être obtenu naturellement à partir de la distillation des branches de certaines plantes, comme celles de la Gaulteria (Gaultheria Procumbens) ou bouleau doux (Bétula lent).
Il peut vous servir: pas de métaux: historique, propriétés, groupes, utilisationsCette substance a été extraite et isolée pour la première fois en 1843 grâce au scientifique d'origine française appelée Auguste Cahours; De Gaulteria, il est actuellement obtenu par la synthèse des laboratoires et même.
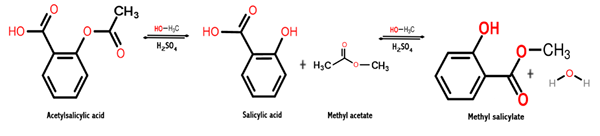
La réaction donnée pour obtenir ce composé chimique est un processus appelé estérification, dans lequel un ester est obtenu par réaction entre un alcool et un acide carboxylique. Dans ce cas, il se produit entre le méthanol et l'acide salicylique, comme indiqué ci-dessous:
Ch3OH + C7H6SOIT3 → C8H8SOIT3 + H2SOIT
Il convient de noter que la partie de la molécule d'acide salicylique qui est estérifiée avec l'alcool hydroxyl (OH).
Ainsi, ce qui se passe entre ces deux espèces chimiques est une réaction de condensation, car la molécule d'eau est éliminée parmi les réactifs tandis que les autres espèces réagissantes sont condensées afin d'obtenir le salicylate de méthyle.
L'image suivante montre la synthèse du salicylate de méthyle de l'acide salicylique, où deux réactions successives sont présentées.