Sels de diazonium

- 4837
- 705
- Paul Dumas
Nous expliquons quels sont les sels de diazonium, comment sont formés leurs propriétés et applications
Quels sont les sels de diazonium?
Le Sels de diazonium Ce sont des composés organiques dans lesquels il y a des interactions ioniques entre le groupe Azo (-N2+) Et un anion x- (Cl-, F-, Ch3Roucouler-, etc.). Sa formule chimique générale est RN2+X-, et en cela, la chaîne latérale R peut être bien un groupe aliphatique ou un groupe aryle; c'est-à-dire une bague aromatique.
Dans l'image inférieure, la structure de l'ion arenodiazonium est représentée. Les sphères bleues correspondent au groupe azo, tandis que le noir et le blanc constituent l'anneau aromatique du groupe phényle. L'AZ+≡n).

Cependant, il existe des structures de résonance qui délocalisent cette charge positive, par exemple, dans l'atome de l'azote voisin: -n = n+. Cela provient lorsque quelques électrons formant un lien sont dirigés vers l'atome d'azote à gauche.
De même, cette charge positive est capable de se décorer à travers le système PI de l'anneau aromatique. En conséquence, les sels de diazonium aromatique sont plus stables que aliphatiques, car la charge positive ne peut pas démocation le long d'une chaîne de carbone (ch3, Ch2Ch3, etc.).
Entraînement
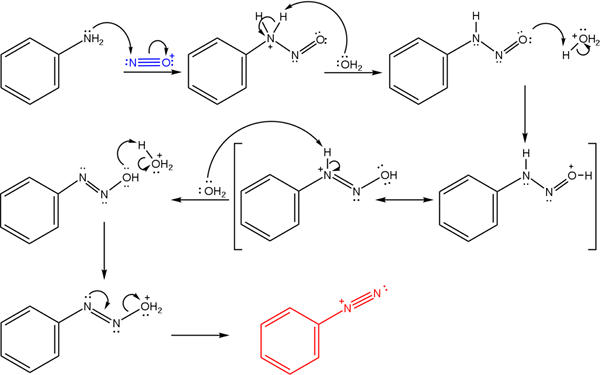
Ces sels dérivent de la réaction d'une amina primaire avec un mélange acide de nitrite de sodium (nano2).
Amines secondaires (r2Nh) et tertiaire (r3N) Autres produits d'azote tels que la N-nitrosoamine (qui sont des huiles jaunâtres), les sels d'amine (R3HN+X-) et composés N-nitrosonium.
L'image supérieure illustre le mécanisme par lequel la formation de sels de diazonium, ou également connue sous le nom de réaction de diazotisation, est régie.
Peut vous servir: Chrome (CR)La réaction commence à partir de la phénylamine (AR-NH2), qui effectue une attaque nucléophile sur l'atome de cation nitrosonium (non+). Ce cation est produit par le mélange nano2/ Hx, où x est généralement Cl; c'est-à-dire HCL.
La formation du cation nitrosonium libère de l'eau au milieu, qui arrête un proton d'azote chargé positivement.
Ensuite, cette même molécule d'eau (ou d'autres espèces acides différentes de H3SOIT+) donner un proton à l'oxygène, démocrant la charge positive dans l'atome d'azote moins électronégatif).
Maintenant, l'eau à nouveau non protégée à l'azote, puis produisant la molécule de diazohydroxyde (l'antipénultimat de la séquence).
Comme le milieu est acide, le diazohydroxyde subit une déshydratation du groupe OH; Pour contrecarrer la vacance électronique, le couple libre du triple lien du groupe Azo.
De cette façon, à la fin du mécanisme, le chlorure de bencodiazonium reste en solution (c6H5N2+CL-).
Propriétés
En général, les sels de diazonium sont incolores et cristallins, solubles et stables à basse température (moins de 5 ° C).
Certains de ces sels sont si sensibles à l'impact mécanique que toute manipulation physique pourrait les faire exploser. Enfin, ils réagissent avec l'eau pour former des phénols.
Réactions de déplacement
Les sels de diazonium sont de l'azote moléculaire potentiel, dont la formation est le dénominateur commun des réactions de déplacement. Dans ceux-ci, une espèce x déplace le groupe azo instable, s'échappant sous le nom de n2(g).
Réaction de sandmeyer
ARN2+ + Cucl => arcl + n2 + Cu+
ARN2+ + Cucn => arcn + n2 + Cu+
Réaction de Gatterman
ARN2+ + Cux => arx + n2 + Cu+
Contrairement à la réaction de Sandmeyer, la réaction de Gatterman a du cuivre métallique au lieu de son halogénure; c'est-à-dire que le Cux est généré In situ.
Réaction de Schimann
[ARN2+] Bf4- => Arf + bf3 + N2
Peut vous servir: cétones: types, propriétés, nomenclature, utilisations, exemplesLa réaction de Schimann est caractérisée par la décomposition thermique du fluoroborate de benzononium.
Réaction de Gomberg bachmann
[ARN2+] Cl- + C6H6 => Ar - c6H5 + N2 + HCL
Autres déplacements
ARN2+ + Ki => ari + k+ + N2
[ARN2+] Cl- + H3Pote2 + H2O => C6H6 + N2 + H3Pote3 + HCL
ARN2+ + H2O => AROH + N2 + H+
ARN2+ + Timbre2 => Arno2 + N2 + Cu+
Réactions redox
Les sels de diazonium peuvent être réduits à des arilhydrazines, en utilisant un mélange de CNCL2/ HCl:
ARN2+ => Arnhnh2
Ils peuvent également être réduits à des arilamines en réduction plus forte avec Zn / HCl:
ARN2+ => Rnah2 + NH4CL
Décomposition photochimique
[ARN2+] X- => Arx + n2
Les sels de diazonium sont sensibles à la décomposition par incidence du rayonnement ultraviolet, ou à des longueurs d'onde très proches.
Réactions de couplage azo
ARN2+ + Ar'h → ARN2Ar '+ h+
Ces réactions sont peut-être les sels de diazonium les plus utiles et les plus polyvalents. Ces sels sont des électrophiles faibles (l'anneau déplace la charge positive du groupe azo). Pour réagir avec les composés aromatiques, ils doivent être chargés négativement, provoquant ainsi des composés azos.
La réaction passe avec des performances efficaces entre un pH de 5 et 7. En pH acide, le couplage est plus faible car les protons du groupe azo, ce qui rend l'attaque de l'anneau négatif impossible.
De plus, en pH de base (supérieur à 10), le sel de diazonium réagit avec OH- Pour produire du diazohydroxyde, qui est relativement inerte.
Les structures de ce type de composés organiques ont un système PI conjugué très stable, dont les électrons absorbent et émettent un rayonnement dans le spectre visible.
Par conséquent, les composés azo sont caractérisés par le fait d'être coloré. En raison de cette propriété, ils ont également été appelés couleurs azoïques.
Peut vous servir: molarité: concentration, unités, calcul, exercices
L'image supérieure illustre le concept du couplage avec l'orange de méthyle comme exemple. Au milieu de sa structure, le groupe Azo peut être observé servant de connecteur des deux anneaux aromatiques.
Lequel des deux anneaux était l'électrophie au début du couplage? Celui à droite, parce que le groupe sulfonate (-so3) Retirer la densité de cycle électronique, ce qui le rend encore plus électrophile.
Applications

L'une de ses applications les plus commerciales est la production de colorants et de pigments, couvrant également l'industrie textile dans les marches en tissu. Ces composés azoïques sont ancrés sur des sites moléculaires spécifiques du polymère, mourant de couleurs.
En raison de sa décomposition photolitique, il est (moins qu'avant) utilisé dans la reproduction de documents. Comme? Les zones en papier recouvertes d'un plastique spécial sont retirées, puis une solution de phénol de base est appliquée, coloriant les lettres ou le design bleu.
Dans la synthèse organique, ils sont utilisés comme points de départ pour de nombreux dérivés aromatiques.
Enfin, ils ont des applications dans le domaine des matériaux intelligents. Dans ceux-ci, une surface (or, par exemple) est liée, ce qui lui permet de donner une réponse chimique aux stimuli physiques externes.

