Réactions exothermiques et endothermiques
- 2777
- 502
- Louna Baron
 La combustion est un exemple de réaction exothermique, car il libère la chaleur. Pour sa part, la glace fond par une réaction endothermique, car elle nécessite une énergie thermique
La combustion est un exemple de réaction exothermique, car il libère la chaleur. Pour sa part, la glace fond par une réaction endothermique, car elle nécessite une énergie thermique Le Réactions exothermiques et endothermiques Ils diffèrent dans le fait que la première libération de l'énergie thermique, tandis que ces derniers l'absorbent, selon les changements de chaleur qui se produisent pendant les réactions chimiques.
De même, d'autres types d'énergie peuvent être impliqués dans les réactions chimiques, car parfois pendant la réaction, l'énergie lumineuse, l'énergie sonore et même l'électricité sont produites.
Pour prendre en compte non seulement la chaleur, mais d'autres types d'énergie, les réactions chimiques sont classées comme exergonique et Endermaniques. Une réaction exergonique libère l'énergie lorsqu'elle est produite, tandis qu'une endégonique l'absorbe.
Dans ce cas, une réaction exothermique est également une réaction exergonique, car elle libère la chaleur. L'un des exemples les plus familiers est la combustion. Chaque fois qu'un morceau de bois est brûlé, une énergie calorique et lumineuse est libérée.
D'un autre côté, l'une des réactions chimiques les plus connues de l'endettement se produit lors de la fusion d'un glaçon, car la glace absorbe l'énergie thermique de l'environnement pour se transformer en eau liquide.
Une réaction exothermique peut se produire spontanément, bien que parfois vous devez faire du travail pour commencer. Cependant, pour qu'une réaction endothermique se produise, il est toujours nécessaire que l'environnement fasse un travail sur le système.
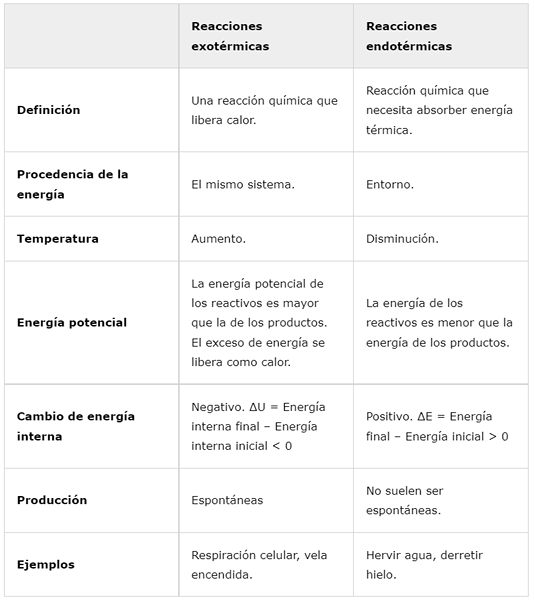
Réactions exothermiques | Réactions endothermiques | |
Définition | Une réaction chimique qui libère la chaleur. | Réaction chimique qui doit absorber l'énergie thermique. |
Origine de l'énergie | Le même système. | Autour. |
Température | Augmenter. | Diminuer. |
Énergie potentielle | L'énergie potentielle des réactifs est supérieure à celle des produits. L'excès d'énergie est libéré sous forme de chaleur. | L'énergie des réactifs est inférieure à l'énergie des produits. |
Changement d'énergie interne | Négatif. ΔU = énergie interne finale - énergie interne initiale < 0 | Positif. ΔE = énergie finale - énergie initiale> 0 |
Production | Spontané | Ils ne sont généralement pas spontanés. |
Exemples | Respiration cellulaire, bougie brûlante. | Faire bouillir l'eau, faire fondre la glace. |
Réactions exothermiques
Définition
Type de réaction chimique qui libère la chaleur lorsqu'elle est effectuée.
Il peut vous servir: Cyclohexen: structure, propriétés, synthèse et utilisationsOrigine de l'énergie
Le même système fournit de l'énergie pour que la réaction se produise.
Température
Après la réaction, il y a un augmenter de température.
Énergie potentielle
Lorsqu'une réaction chimique se produit entre les réactifs, des liens sont rompus entre eux et d'autres se forment pour créer de nouvelles molécules. Mais tous les liens n'unirent pas les atomes et les molécules avec la même force, donc l'énergie pour briser ou créer chaque lien est différente.
Pendant chaque réaction, ils se brisent et créent différents nombres de liens, donc l'énergie est différente. Dans une réaction exothermique, l'énergie potentielle des réactifs est plus vieux que celui des produits, et puisque l'énergie est préservée, l'excès est libéré sous forme de chaleur.
Changement d'énergie interne
L'énergie interne est liée à la capacité du système à effectuer un travail et comprend son énergie potentielle et son énergie cinétique. L'énergie absolue du système n'est pas déterminée, mais sa variation, appelée ΔU.
Selon ce qui a été dit dans la section précédente, le changement d'énergie interne ΔU est négatif.
ΔU = énergie interne finale - énergie interne initiale < 0
Production
La plupart des réactions exothermiques sont spontané, c'est-à-dire qu'ils se déroulent par eux-mêmes, sans avoir besoin d'ajouter de l'énergie externe, jusqu'à ce que les réactifs soient épuisés.
Exemples
Normalement, les réactions d'oxydation et celles qui conduisent à la formation de composés sont généralement des réactions exothermiques:
1. Dissoudre le détergent dans l'eau
Lors de la dissolution des vêtements dans un peu d'eau froide, il se sent chaud en le touchant.
2. Respiration cellulaire
Chez les animaux et les plantes, le processus de respiration cellulaire est effectué dans le cadre du cycle du carbone. La respiration utilise du glucose et de l'oxygène pour retourner le dioxyde de carbone, l'eau et l'énergie, selon la réaction:
Peut vous servir: oxyde de titane (iv): structure, propriétés, utilisationsC6H12SOIT6 + 6e2 → 6CO2 + H2O + énergie (ATP)
3. Une bougie brûlante
En plus de la lumière, une bougie brûlante dégage de la chaleur et d'autres substances:
Oxygène oxygène → eau + dioxyde de carbone + lumière et chaleur
4. Le bombardement
Cet insecte se défend en saupoudant un aérosol sur ses prédateurs. Le scarabée garde les liquides et les enzymes dans des compartiments séparés, situés dans son abdomen.
Lorsqu'il est menacé, il expulse les fluides vers le compartiment enzymatique et une réaction chimique qui génère de la vapeur et la chaleur est produite, agissant comme un répulsif pour les prédateurs possibles.
5. Laine d'acier et de vinaigre
Un métal comme le fer est lentement oxydé lorsqu'il réagit avec l'environnement, mais si du vinaigre est ajouté à une petite laine d'acier, il est observé que l'oxydation est beaucoup plus rapide et génère en même temps de la chaleur.
Réactions endothermiques
Définition
Réactions dans lesquelles les réactifs doivent absorber l'énergie thermique afin que les produits soient obtenus.
Origine de l'énergie
L'énergie nécessaire à la réaction à effectuer se produit de l'environnement.
Température
La réaction endothermique implique un diminuer de température.
Énergie potentielle
Contrairement à ce qui se passe avec une réaction exothermique, l'énergie des réactifs C'est moins que l'énergie des produits.
Changement d'énergie interne
Dans une réaction endothermique, le changement d'énergie interne ΔE est positif.
ΔE = énergie finale - énergie initiale> 0
Par conséquent, l'énergie finale est supérieure à celle initiale.
Production
Les réactions endothermales nécessitent que des travaux sur le système soient effectués, donc ils ne sont généralement pas spontanés.
Cependant, il y a des réactions endothermiques, comme la fusion de la glace et l'évaporation de certains liquides, qui sont spontanés à température ambiante.
Il est alors conclu que la température de l'environnement est un facteur déterminant dans la spontanéité d'une réaction chimique.
Il peut vous servir: Indicateurs chimiques: à quoi servent-ils, types, exemplesExemples
De nombreuses réactions impliquant la dissolution des sels et, en général, la décomposition des substances, sont généralement endothermiques. De la même manière, le passage de la glace à l'eau liquide et de l'eau liquide à la vapeur, c'est-à-dire les transformations de l'État, sont également des réactions endothermiques.
1. Photosynthèse
Les plantes effectuent une réaction chimique en présence de la lumière du soleil, dans laquelle ils convertissent le dioxyde de carbone et l'eau en glucose et en oxygène. La chlorophylle est la molécule clé de ce processus, dont la réaction chimique est:
Lumière + 6CO2 + H2O → C6H12SOIT6 + 6e2
Comme on peut le voir, c'est la réaction inverse de la respiration. Pour produire un kilogramme de glucose, 15 méga joules d'énergie solaire sont nécessaires.
2. Faire bouillir l'eau et cuire
Une réaction très courante, qui nécessite de l'énergie pour procéder, est l'eau bouillante:
H2O (liquide) + énergie → H2O (vapeur)
Les aliments nécessitent normalement de l'eau pour la cuisson et de la même manière que l'eau qu'ils contiennent doit s'évaporer pour les cuire, ce qui implique un changement d'État.
3. Faire fondre la glace
De même, il est courant que la glace fonde à température ambiante, si cela est supérieur à 0 ° C:
H2O (solide) + énergie → h2O (liquide)
Par conséquent, la boisson refroidit lors de l'ajout de glace, car elle absorbe l'énergie nécessaire pour changer l'état du liquide.
4. Sacs froids
Ils sont utilisés pour traiter les ecchymoses et les coups. Contenir de l'eau et une enveloppe avec du chlorure d'ammonium. Lors du tapotement du sac, l'enveloppe est brisée et la réaction du chlorure d'ammonium avec de l'eau, qui est endothermique, refroidit le sac et soulage la douleur.
5. Production d'ozone
Le rayonnement ultraviolet du soleil transforme l'oxygène en ozone, libérant la chaleur dans le processus.
3e2 (gaz) + lumière ultraviolette → 2e3 (gaz)
Les références
- Byju's. Différence entre les réactions édothermiques et exothermiques. Récupéré de byjus.com
- Chang, R. (2013). Chimie. 11va. Édition. McGraw Hill Education.
- Greane. Réactions exothermiques pour chauffer les choses. Récupéré de: Grelane.com.
- Hein, m. (2014). Fondations de la chimie du collège. Wiley.
- Helmestine, un. Comprendre les réactions endothermiques et exothermiques. Récupéré de: Thoughtco.com

