Réaction en endorgonique

- 2394
- 731
- Justine Charpentier
 Une réaction endary est que non-spontanée et qui nécessite beaucoup d'énergie
Une réaction endary est que non-spontanée et qui nécessite beaucoup d'énergie Qu'est-ce qu'une réaction endary?
Ongle Réaction en endorgonique C'est celui qui n'est pas spontané et nécessite également un approvisionnement à haute énergie. En chimie, cette énergie est généralement la calorique. Les réactions endothermiques les plus connues de toutes les réactions endothermiques sont les réactions endothermiques.
La raison pour laquelle toutes les réactions ne sont pas spontanées est parce qu'elles consomment de l'énergie, et les systèmes formés par les espèces impliquées diminuent leur entropie. En d'autres termes, à des fins chimiques, ils deviennent moléculairement plus ordonnés.
Construire un mur de briques est un exemple de réaction endary. Les briques seules ne sont pas assez compactes pour former un corps solide. En effet, il n'y a pas de gain d'énergie qui favorise son syndicat (également reflété dans ses possibles interactions intermoléculaires faibles).
Pour construire le mur, vous avez besoin de ciment et de travail. C'est l'énergie, et la réaction non spontanée (le mur ne sera pas construit automatiquement) devient possible si un avantage énergétique est perçu (économique, dans le cas du mur).
S'il n'y a aucun avantage, le mur s'effondrera à toute perturbation, et leurs briques ne peuvent jamais rester unies. Il en va de même pour de nombreux composés chimiques, dont les blocs de construction ne peuvent pas rejoindre spontanément.
Caractéristiques d'une réaction endary
- Ce n'est pas spontané.
- Absorber la chaleur (ou tout autre type d'énergie).
La raison en est que leurs produits ont plus d'énergie que les réactifs impliqués dans la réaction. Ce qui précède peut être représenté avec l'équation suivante:
Δg = gproduits-gRéactifs
Où Δg est le changement de l'énergie libre des gibbs. Comme gProduit est plus grand (car il est plus énergique) que gRéactifs, La soustraction doit être supérieure à zéro (Δg> 0). L'image suivante résume la nouvelle explication:
Peut vous servir: sulfate de sodium (NA2SO4): structure, propriétés, utilisations, obtention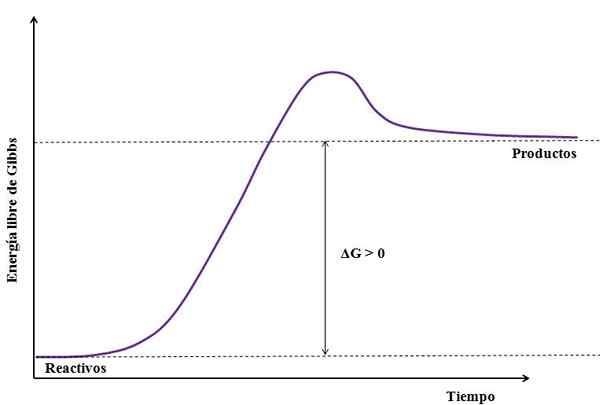 Figure d'une réaction endergonique. Source: Gabriel Bolívar
Figure d'une réaction endergonique. Source: Gabriel Bolívar Notez la différence entre les états énergétiques entre les produits et les réactifs (ligne violette). Par conséquent, les réactifs ne se transforment pas en produits (a + b => c) s'il n'y a pas d'absorption de chaleur en premier.
Augmenter l'énergie énergétique libre
Chaque réaction endergonique a une augmentation de l'énergie libre du système du système. Si pour une certaine réaction, il est accompli que ΔG> 0, alors il ne sera pas spontané et nécessitera une alimentation énergétique pour être effectuée.
Comment savoir mathématiquement si une réaction est endegonique ou non? Appliquer l'équation suivante:
ΔG = ΔH-TΔS
Lorsque ΔH est l'enthalpie de la réaction, c'est-à-dire l'énergie totale libérée ou absorbée, ΔS est le changement d'entropie, et t la température. Le facteur TΔS est la perte d'énergie non exploitée dans l'expansion ou l'ordre des molécules en phase (solide, liquide ou soda).
Ainsi, ΔG est l'énergie que le système peut utiliser pour effectuer un travail. Car ΔG a un signe positif pour une réaction endary, l'énergie ou le travail (réactifs) doit être appliqué pour obtenir les produits.
Ainsi, en connaissant les valeurs ΔH (positif, pour une réaction endothermique, et négatif, pour une réaction exothermique) et TΔS, vous pouvez savoir si la réaction est terminale -gonique.
Cela signifie que, bien qu'une réaction soit endothermique, Non C'est nécessairement endogonique.
Le glaçon
Par exemple, un glaçons fond dans la chaleur absorbant l'eau liquide, ce qui aide à séparer ses molécules; Cependant, le processus est spontané et, par conséquent, ce n'est pas une réaction endary.
Dans le cas où la glace est fondée à une température bien inférieure à -100 ° C, le terme TΔS de l'équation d'énergie libre devient faible par rapport à ΔH (parce que t diminue), et en conséquence, ΔG aura une valeur positive.
Peut vous servir: acide carboxyliqueEn d'autres termes: faire fondre la glace en dessous de -100 ° C est un processus endégonique, et il n'est pas spontané. Un cas similaire consiste à geler l'eau d'environ 50 ° C, ce qui ne se produit pas spontanément.
Les liens de leurs produits sont plus faibles
Une autre caractéristique importante, également liée à ΔG, est l'énergie des nouveaux liens. Les liens des produits formés sont plus faibles que ceux des réactifs.
Cependant, la diminution de la force des liens est compensée par un gain de masse, qui se reflète dans les propriétés physiques.
Ici, la comparaison avec le mur de briques commence à perdre du sens. Selon ce qui précède, les barres à l'intérieur des briques doivent être plus fortes que celles entre elles et le ciment. Cependant, le mur dans son ensemble est plus rigide et résistant à une plus grande masse.
Il est associé à des réactions exergoniques
Si les réactions de fin ne sont pas spontanées, comment se déroulent-ils dans la nature? La réponse est due au couplage avec d'autres réactions assez spontanées (exergoniques) et qui favorisent en quelque sorte leur développement.
Par exemple, l'équation chimique suivante représente ce point:
A + b => c (réaction endergonique)
C + d => e (réaction exergonique)
La première réaction n'est pas spontanée, donc naturellement ça ne pouvait pas arriver. Cependant, la production de C permet à la deuxième réaction de se produire, provoquant et.
Ajout d'énergies libres de gibbs pour les deux réactions, ΔG1 et Δg2, Avec un résultat inférieur à zéro (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Il peut vous servir: hydroorsSi C ne réagissait pas avec D, je ne pourrais jamais le former, pour ne pas avoir de compensation d'énergie (comme le cas de l'argent avec le mur de briques). Il est alors dit que C et D "Jalan" à A et B pour réagir, même étant une réaction endegonique.
Exemples de réactions endergoniques
Photosynthèse
Les plantes utilisent l'énergie solaire pour créer des glucides et de l'oxygène à partir du dioxyde de carbone et de l'eau. Le co₂ et o2, De petites molécules avec des liaisons fortes, forment des sucres, de structures TARRY, qui sont plus lourdes, solides et fondent à une température d'environ 186 ° C.
Notez que les liens C-C, C-H et C-O sont plus faibles que ceux de O = C = O et O = O. Et à partir d'une unité de sucre, la plante peut synthétiser les polysaccharides, comme la cellulose.
Synthèse des biomolécules et des macromolécules
Les réactions endermaniques font partie des processus anabolisants. Comme les glucides, d'autres biomolécules, telles que les protéines et les lipides, nécessitent des mécanismes complexes qui sans eux, et le couplage avec la réaction d'hydrolyse de l'ATP, il ne pouvait y avoir.
La formation de diamants et de composés lourds de brut
Les diamants nécessitent d'énormes pressions et températures, de sorte que leurs composants peuvent se compacter dans un solide cristallin.
Cependant, certaines cristallisations sont spontanées, bien qu'elles passent à des vitesses très lentes (la spontanéité n'est pas liée à la cinétique de la réaction).
Enfin, le pétrole brut représente à lui seul un produit de réactions endergoniques, en particulier des hydrocarbures lourds ou des macromolécules appelées asphalte.
Leurs structures sont très complexes et leur synthèse nécessite beaucoup de temps (des millions d'années), la chaleur et l'action bactérienne.
Autres exemples
- Respiration cellulaire des plantes.
- Le transport de l'oxygène dans la circulation sanguine.
- La diffusion des ions à travers les membranes cellulaires.
- Contraction musculaire.
- Synthèse des protéines cellulaires.
Les références
- Réactions d'endermaniques et exeriques. Récupéré de Quimitube.com
- Énergie gratuite. Récupéré de es.Khanacademy.org
- Définition de la réaction endergonique. Récupéré de la biologie.filet

