Chimie analytique

- 994
- 137
- Prof Noah Collet

Qu'est-ce que la chimie analytique?
La chimie analytique C'est la branche de la chimie qui se consacre à l'étude ou à l'analyse (d'où son nom) la composition du sujet. Cela signifie qu'il est chargé de déterminer quelles substances sont faites, ainsi que dans quelle proportion ses composants sont.
Il s'agit d'une discipline purement expérimentale qui combine les connaissances et les compétences de différents domaines qui vont des statistiques à la physique moderne et optique pour développer des méthodes analytiques qui permettent de déterminer, avec un niveau de confiance adéquat, ce qu'un échantillon contient.
En plus de son importance dans la recherche scientifique fondamentale, cette branche de la chimie est appliquée dans pratiquement toutes les industries. En effet.
Bref historique de la chimie analytique
Les origines de la chimie analytique peuvent être attribuées aux œuvres d'Antoine Lavoisier à la fin du XVIIIe siècle, qui ont mené des études importantes liées à la composition des minéraux et de l'air, ainsi que de la combustion et du processus de respiration animale.
 Lavoisier
Lavoisier Cependant, ce n'est que le XIXe siècle que l'apprenti pharmaceutif allemand Carl Freseenius Mohr développé ce qui serait les premières marches analytiques pour déterminer la composition qualitative d'un échantillon. Le livre publié par Mohr est considéré comme le premier texte de la chimie analytique, et bon nombre de ses principes sont toujours enseignés aujourd'hui en classe.
Mohr a fait plus que publier ses découvertes. Il a également inventé des techniques volumétriques et conçu et construit certains des instruments d'analyse volumétriques les plus importants en chimie analytique, tels que les pipettes volumétriques et la bureautte.
De plus, dans son laboratoire de Francfort, il a formé de nombreux autres apprentis dans les techniques qu'il a développées. En plus des techniques quantitatives telles que la volumétrie et la gravimétrie, il a également enseigné les techniques d'analyse chimique qualitative. Pour cela et bien plus encore, il est considéré comme le père de la chimie analytique.
Branches de chimie analytique
La chimie analytique peut être divisée, en traits larges, en deux classes, selon l'objectif de l'analyse chimique:
Chimie analytique qualitative
Le premier problème qui cherche à résoudre la chimie analytique est de déterminer ce qui contient un échantillon inconnu. C'est-à-dire trouver ou identifier quels sont leurs composants. Ce type d'analyse est appelé analyse qualitative, donc cette branche de la chimie analytique est également appelée chimie analytique qualitative.
Peut vous servir: fer (élément): caractéristiques, structure chimique, utilisationsChimie analytique quantitative
Cette branche de la chimie analytique est chargée de déterminer la quantité de chaque composant dans un échantillon. C'est-à-dire qu'il cherche à mesurer dans quelle quantité, proportion ou concentration sont les différents composants, qui sont appelés analytes.
Dans la plupart des cas, l'analyse quantitative est toujours précédée d'une analyse qualitative, car il ne peut pas être déterminé à quel point il existe un analyte dans un échantillon s'il ne sait pas quelles analyses il y a dans le même.
C'est pourquoi, sauf à quelques occasions où il est connu à l'avance ce qui est analysé, la chimie analytique qualitative et quantitative va toujours ensemble.
méthodes analytiques
La chimie analytique utilise à la fois des méthodes qualitatives et quantitatives pour comprendre la composition de la matière:
1. Méthodes qualitatives
Les méthodes qualitatives sont basées sur des réactions chimiques telles que les précipitations et la formation complexe, ainsi que l'utilisation de techniques de séparation pour identifier les composants d'un échantillon. Ce sont des méthodes classiques et incluent les exemples suivants:
- Marches analytiques cationiques: Ensemble systématique de tests chimiques qui identifient la présence de certains cations métalliques.
- Marches analytiques anioniques: Ensemble systématique de tests chimiques qui confirment la présence de certains anions communs.
- Tests de flamme: Une analyse simple qui vous permet d'identifier certains métaux en fonction de la couleur de la flamme lorsque l'échantillon est brûlé.
2. Méthodes quantitatives
Ceux-ci consistent à déterminer la concentration d'une espèce dans un échantillon. Les méthodes analytiques sont généralement divisées en techniques humides classiques telles que la volumétrie et la gravimétrie, ainsi que des techniques instrumentales modernes telles que les techniques spectrométriques et la chromatographie, qui seront expliquées ci-dessous:
-
Méthodes d'analyse volumétrique
 Analyste chimique en réalisant un diplôme
Analyste chimique en réalisant un diplôme La volumétrie fait référence à un ensemble de techniques pour la détermination indirecte de la concentration d'un analyte dans un échantillon ou dans une aliquote de même, en fonction de la mesure du volume d'un réactif de concentration connu qui est nécessaire pour consommer stoechiométriquement l'analyte. Ces techniques sont également appelées diplômes ou évaluations.
Peut vous servir: oxácidoToutes les méthodes volumétriques sont basées sur la recherche du point d'équivalence, dans lequel il est réalisé que:
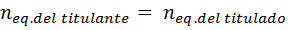
Comme les équivalents sont égaux à la concentration normale par le volume et que la concentration du titulaire est connue, la mesure de son volume implique que le nombre d'équivalents du titler sera connu, et donc de l'analyte ou intitulé, comme indiqué à la continuation:
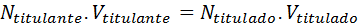
Il existe de nombreuses méthodes analytiques basées sur la volumétrie, qui diffèrent en fonction du type de réaction chimique qu'ils utilisent. Selon cela, les types suivants de méthodes volumétriques peuvent être distingués:
-
- Volumétrie acide-base: Dans ces cas, soit l'analyte est un acide et le titre de base A, soit le contraire. La réaction est une neutralisation acide-base et le point final du degré est déterminé par le changement de couleur d'un indicateur chimique.
- Volumétrie des précipitations: Dans cette technique, la réaction impliquée est la formation d'un précipité insoluble.
- Évaluation ou volumétrie de la formation complexe: Dans ce cas, la réaction est la formation d'un complexe métallique, parfois coloré, parfois pas.
- Volumétrie redox: Il se réfère à la volumétrie qui implique une réaction d'oxydation et de réduction entre le titulaire et l'analyte. L'un joue le rôle de l'agent oxydant et l'autre du réducteur.
-
Méthodes d'analyse gravimétrique
 Échelles analytiques utilisées dans l'analyse gravimétrique
Échelles analytiques utilisées dans l'analyse gravimétrique Contrairement au cas précédent, ces méthodes sont basées sur la mesure de la masse ou le changement de masse d'un échantillon après avoir été soumis à différents types de traitements chimiques et thermiques.
Quelques exemples de méthodes gravimétriques courantes dans le laboratoire de chimie analytique sont:
-
- Méthodes de précipitation: Dans ces cas, l'analyte est généralement un ion qui est précipité quantitativement sous la forme d'un sel insoluble. Dit sel filtres et séchage, puis déterminer sa masse. Avec cette masse, la quantité de l'analyte dans l'échantillon d'origine est alors déterminée.
- Méthodes de volatilisation: Contrairement à la précédente, l'analyte dans ce cas est séparé de la matrice de l'échantillon sous la forme d'un gaz. Dans certaines méthodes, ce gaz est collecté en réagissant avec un réactif adéquat, puis en pesant le produit de ladite réaction. Dans d'autres, la masse du gaz est déterminée au moyen de la différence de poids avant et après la volatilisation.
- Électrodéposition: Il est similaire aux méthodes de précipitation, à l'exception du fait que l'analyte est déposé sur une électrode en raison d'une réaction redox générée par un courant électrique. L'augmentation de la masse d'électrode permet de déterminer la quantité d'analyte dans l'échantillon.
-
Méthodes instrumentales
 Instrument analytique automatisé
Instrument analytique automatisé Les méthodes analytiques modernes sont principalement basées sur l'utilisation d'instruments scientifiques avancés qui sont capables d'analyser des échantillons complexes efficacement, précisément et, dans certains cas, automatisés. Ces méthodes sont basées sur la mesure de certaines propriétés physiques qui peuvent être corrélées avec la concentration de l'analyte dans l'échantillon.
Peut vous servir: Métaux alcalins: propriétés physiques et chimiques, utilisations, obtentionCertaines techniques mesurent les différences de potentiel électrique ou d'intensités de courant, tandis que d'autres mesurent la quantité de lumière émise ou absorbée par des atomes ou des molécules à des longueurs d'onde spécifiques. Quelques exemples de méthodes analytiques instrumentales sont:
-
- Méthodes spectrométriques: Ces méthodes sont basées sur le phénomène d'absorption de la lumière par les atomes et les molécules, ou sur l'émission de lumière lorsque les atomes sont chauffés à des températures élevées. Dans le premier cas, les techniques sont appelées spectrométrie d'absorption (atomique ou moléculaire comme le cas peut l'être) et dans la seconde, ils sont appelés spectrométrie d'émission atomique.
- Méthodes électroanalytiques: Contrairement aux précédents, ces changements de modification de l'électricité ou des propriétés électriques d'un échantillon en présence de l'analyte. Cela comprend les mesures d'intensité de courant (comme dans le cas de la polarographie), la tension (comme dans le cas des méthodes de pH), la conductivité électrique, etc.
-
Méthodes chromatographiques
La chromatographie peut être considérée comme une classe en dehors d'une méthode analytique distincte, car elle comprend la séparation, l'identification qualitative et la quantification tout en un. Ces méthodes peuvent être combinées avec des techniques volumétriques ou instrumentales pour l'analyse des analytes distincts.
Dans cette technique, un échantillon complexe se dissout dans un solvant adéquat et traverse un matériau poreux tel qu'un gel, un papier filtre ou un sable fin, poussé par le même solvant.
Les différents solutés présents dans l'échantillon auront des affinités différentes en raison du matériau poreux, donc certains se déplaceront plus rapidement que d'autres. En fin de compte, les fractions qui partent pour analyse sont collectées ou analysées en ligne au moyen d'un spectromètre d'absorption.

