Quelles sont l'anode et la cathode?

- 4167
- 133
- Raphaël Meyer
Il anode et cathode Ce sont les types d'électrodes trouvés dans les cellules électrochimiques. Ce sont des appareils capables de produire de l'électricité par une réaction chimique. Les cellules électrochimiques les plus utilisées sont les batteries.
Il existe deux types de cellules électrochimiques, de cellules électrolytiques et de cellules galvaniques ou voltaïques. Dans les cellules électrolytiques, la réaction chimique produite par l'énergie ne se produit pas spontanément, mais le courant électrique est transformé en une réaction d'oxydation chimique.

La cellule galvanique est composée de deux semi -logs. Ceux-ci sont reliés par deux éléments, un conducteur métallique et un pont saline.
Le conducteur électrique, comme indiqué par son nom, mène l'électricité parce qu'il a très peu de résistance au mouvement de la charge électrique. Les meilleurs conducteurs sont généralement des métaux.
Le pont saline est un tube qui relie les deux semi-llades, tout en maintenant leur contact électrique, et sans laisser les composants de chaque cellule.Chaque semi-média de la cellule galvanique contient une électrode et un électrolyte.
Lorsque la réaction chimique se produit, l'un des semi-llades perd des électrons à son électrode, par le processus d'oxydation; tandis que les autres gagnent des électrons pour l'électrode, grâce au processus de réduction.
Les processus d'oxydation sont produits dans l'anode et les processus de réduction de la cathode
[TOC]
Anode
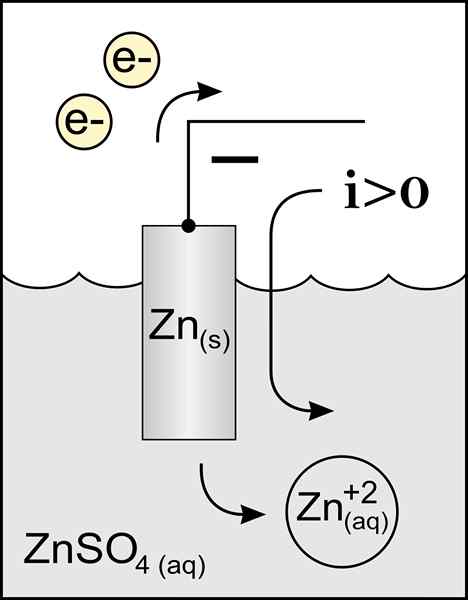 Diagramme d'une anode de zinc dans une cellule voltaïque. Source: Travail original: Fichier: Zinc Anode 2.PNG par utilisateur: Micheljullian (Talk) Travail dérivé: KES47 / CC BY-S (http: // CreativeCommons.Org / licences / by-sa / 3.0 /)
Diagramme d'une anode de zinc dans une cellule voltaïque. Source: Travail original: Fichier: Zinc Anode 2.PNG par utilisateur: Micheljullian (Talk) Travail dérivé: KES47 / CC BY-S (http: // CreativeCommons.Org / licences / by-sa / 3.0 /) Le nom de l'anode vient du grec ανά (aná): up et οδός (odós): chemin. Faraday a été celui qui a inventé ce terme au XIXe siècle.
La meilleure anode déterminante est l'électrode qui perd des électrons dans une réaction d'oxydation. Normalement, il est lié au pôle positif du transit du courant électrique, mais ce n'est pas toujours le cas.
Peut vous servir: solutions appréciéesBien que dans les batteries, l'anode soit le pôle positif, dans les lumières LED, c'est l'opposé, l'anode étant le pôle négatif.
Normalement, le sentiment de courant électrique est défini, l'appréciant comme un sentiment de charges libres, mais si le conducteur n'est pas métallique, les charges positives produites sont transférées sur le conducteur externe.
Ce mouvement implique que nous avons des charges positives et négatives qui se déplacent dans des sens opposés, il est donc dit que la direction du courant est la voie des charges positives des cations qui sont dans l'anode vers la charge négative des anodes des anodes que l'on trouve dans la cathode.
Dans les cellules galvaniques, ayant un conducteur métallique, le courant généré dans la réaction suit le chemin du pôle positif au négatif.
Mais dans les cellules électrolytiques, n'ayant pas de conducteur métallique, mais un électrolyte, des ions avec une charge positive et négative qui se déplacent dans des sens opposés peuvent être trouvés.
Les anodes thermoioniques reçoivent la plupart des électrons qui proviennent de la cathode, chauffent l'anode et doivent trouver un moyen de se dissiper. Cette chaleur est générée dans la tension qui se produit entre les électrons.
Anodes spéciales
Il existe un type d'anodes spéciales, telles que celles de X-Rays. Dans ces tubes, l'énergie produite par les électrons, en plus de produire des rayons x, génère une grande énergie qui chauffe l'anode.
Cette chaleur se produit à la tension différente entre les deux électrodes et qui exerce une pression sur les électrons. Lorsque les électrons se déplacent dans le courant électrique, ils ont frappé l'anode en transmettant leur chaleur.
Peut vous servir: Équation de Henderson-Haselbalch: explication, exemples, exerciceCathode
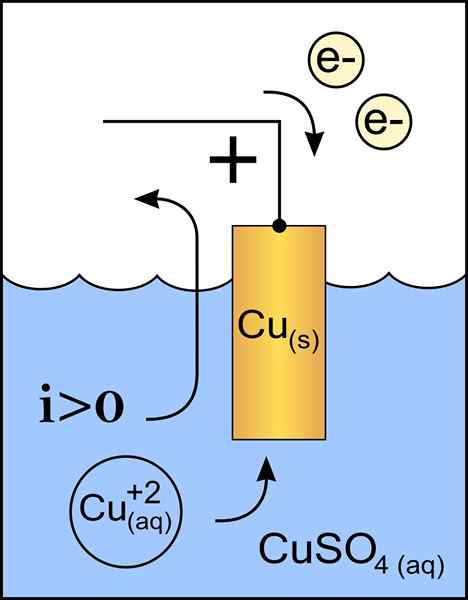 Diagramme de cuivre en cuivre dans une cellule voltaïque. Source: Travail original: Fichier: Zinc Anode 2.PNG par utilisateur: Micheljullian (Talk) Travail dérivé: KES47 / CC BY-S (http: // CreativeCommons.Org / licences / by-sa / 3.0 /)
Diagramme de cuivre en cuivre dans une cellule voltaïque. Source: Travail original: Fichier: Zinc Anode 2.PNG par utilisateur: Micheljullian (Talk) Travail dérivé: KES47 / CC BY-S (http: // CreativeCommons.Org / licences / by-sa / 3.0 /) La cathode est l'électrode avec une charge négative, qui dans la réaction chimique subit une réaction de réduction, où son état d'oxydation est réduit lorsqu'il reçoit des électrons.
Comme pour l'anode, c'est Faraday qui a suggéré le terme cathode qui vient du grec κατά [Catá]: `` Down ', et ὁδός [odós]:' road ''. À cette électrode, la charge négative a été attribuée au fil du temps.
Cette approche était fausse, car selon l'appareil dans lequel il est situé, il a une charge ou une autre.
Cette relation avec le pôle négatif, comme avec l'anode, provient de l'hypothèse que le courant circule du pôle positif au négatif. Cela se produit à l'intérieur d'une cellule galvanique.
Dans les cellules électrolytiques, les moyens de transfert d'énergie, comme il n'est pas dans un métal mais dans un électrolyte, peut coexister des ions négatifs et positifs qui se déplacent dans des sens opposés. Mais par accord, il est dit que le courant va de l'anode à la cathode.
Cathodes spéciales
Un type de cathodes spécifiques sont des cathodes thermioniques. Dans ceux-ci, la cathode émet des électrons en raison de l'effet de la chaleur.
Dans les valves thermioniques, la cathode peut se chauffer en faisant circuler un courant de chauffage dans un filament qui l'a couplé.
Réaction d'équilibre
Si nous prenons une cellule galvanique, qui est la cellule électrochimique la plus courante, nous pouvons formuler la réaction d'équilibre générée.
Chaque semi-média qui forme la cellule galvanique, a une tension caractéristique appelée potentiel de réduction. Dans chaque semi-média, il y a une réaction d'oxydation entre les différents ions.
Peut vous servir: spectre d'absorptionLorsque cette réaction atteint un équilibre, la cellule ne peut pas fournir plus de tension. À l'heure. Le potentiel de la réaction sera plus élevé, plus il est atteint d'équilibre.
Lorsque l'anode est en équilibre, il commence à perdre des électrons qui traversent le conducteur jusqu'à la cathode.
Dans la cathode, la réaction de réduction se déroule, plus l'équilibre le plus potentiel aura la réaction lors de la production et de la prise des électrons qui proviennent de l'anode.
Les références
- Huheey, James et., et al.Chimie inorganique: principes de structure et de réactivité. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, un.Chimie: principes et propriétés. New York, États-Unis: McGraw-Hill, 1966.
- Brady, James et.Chimie générale: principes et structure. Wiley, 1990.
- Petrucci, Ralph H., et al.Chimie générale. Fonds éducatif inter-américain, 1977.
- Masterton, William L.; Hurley, Cecile n.Chimie: principes et réactions. Cengage Learning, 2015.
- Charlot, Gaston; Tremillon, Bernard; BADOZ-LAMING, J. Réactions électrochimiques. Toray-Masson, 1969.
- « Les 10 contributions et inventions les plus importantes
- Caractéristiques Quetzal, habitat, reproduction, nourriture »

