Qu'est-ce que la cinétique chimique?

- 3006
- 6
- Paul Dumas
Nous expliquons ce qu'est la cinétique chimique, l'ordre et la vitesse de réaction, et les facteurs qui affectent la vitesse
Qu'est-ce que la cinétique chimique?
La cinétique chimique C'est la branche de la chimie qui est responsable de l'étude de la vitesse des réactions chimiques, quels facteurs affectent cette vitesse et quels sont les mécanismes individuels ou les étapes par lesquelles les réactions chimiques se produisent.
De plus, cela nous permet de comprendre de nombreux aspects des réactions chimiques telles que l'équilibre chimique et l'énergie d'activation, et étudie les processus de catalyse. Ce dernier le rend particulièrement important dans plusieurs applications, de la biochimie à l'ingénierie industrielle.
Au centre de la cinétique se trouve la vitesse de réaction, qui peut être comprise comme la vitesse à laquelle les réactifs sont transformés en produits. Cependant, dans la cinétique chimique, il y a une définition beaucoup plus précise.
Définition de la vitesse de réaction
Pour donner la définition complète de la vitesse de réaction, comme utilisé dans la cinétique chimique, commençons par la réaction chimique générique suivante:
Dans cette réaction, A et B représentent les réactifs, C et D représentent des produits, tandis que A, B, C et d Ils représentent les coefficients stoechiométriques respectifs.
La vitesse de réaction (représentée avec le symbole V) Indique à quelle vitesse. Mathématiquement, cela s'exprime comme suit:
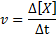
Où Δ [x] représente le changement de concentration molaire de l'espèce x (a, b, c ou d) dans l'intervalle de temps Δt.
Il est évident que plus les réactifs sont plus rapides, plus les autres réactifs seront plus rapides et plus les produits se produiront rapidement. Pour cette raison, il est seulement nécessaire de définir la vitesse en termes de l'un d'eux.
Il peut vous servir: méthodes de séparation des mélanges homogènesPour s'assurer que le résultat du calcul de la vitesse est toujours le même, quelle que soit l'espèce que la vitesse est définie, elle doit toujours être divisée entre le coefficient stoechiométrique et placer un signe moins avant l'équation s'il s'agit d'un réactif. C'est-à-dire:
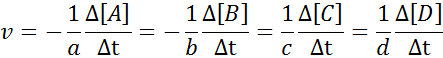
Exemple de définition de la vitesse de réaction
Étant donné la réaction chimique suivante:
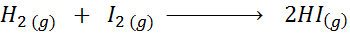
Écrivez la définition de la vitesse de réaction en fonction de chaque espèce impliquée.
Solution:
En termes de h2:
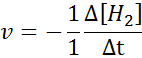
En termes de i2:
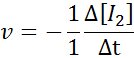
En termes de hi:
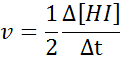
La loi de vitesse et l'ordre de réaction
Les réactions se produisent lorsque les atomes et les molécules entrent en collision les uns avec les autres avec une énergie suffisante et une orientation appropriée. La probabilité que cela se produise augmente à mesure que les atomes et les molécules sont plus concentrés.
Pour cette raison, la vitesse dépend presque toujours de la concentration de réactifs. Dans certains cas, la vitesse dépend également de la concentration de l'un des produits, ainsi que de la concentration de tout catalyseur ou inhibiteur qui est présent dans l'environnement.
L'équation mathématique qui relie la vitesse d'une réaction à la concentration des différentes espèces impliquées est appelée "Droit de vitesse»Et, dans des cas plus simples, il a le formulaire suivant:
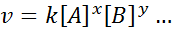
Où k C'est une constante de proportionnalité appelée Conclusion de vitesse, et les exposants de a, b et toute autre espèce qui apparaît dans l'équation, sont appelés ordres de réaction.
Selon la somme de tous les ordres de réaction (qui est appelé ordre global), différents types de réactions peuvent être distingués. Ceux-ci diffèrent de la façon dont la concentration affecte la vitesse, dans la formule du temps nécessaire pour consommer la moitié des réactifs (demi-vie) et dans la façon dont la concentration des réactifs change dans le temps (les graphiques [a] vs t ).
-
Réactions de commande 0
Lorsque tous les exposants de la loi sur la vitesse sont 0, l'équation de la loi de vitesse est réduite à:
Peut vous servir: lien covalent coordonné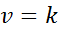
En d'autres termes, ce sont des réactions qui se produisent à vitesse constante et dans laquelle la vitesse ne dépend pas de la concentration d'un réactif ou d'un produit.
Graphiques de commande 0
Le graphique de [a] vs t de réactions d'ordre 0.
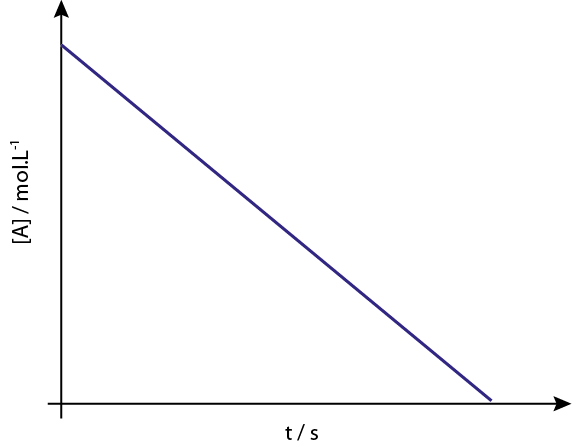
Légende: le graphique de concentration vs le temps d'une réaction de l'ordre 0 donne une ligne droite.
Vie intermédiaire pour la commande 0
Pour une réaction de l'ordre 0, le temps de la demi-vie (t1/2) Est donné par:
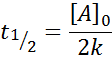
-
Réactions d'ordre du 1er ordre
Dans ces réactions, la vitesse varie linéairement avec la concentration. La loi sur la vitesse du premier ordre est:
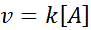
Graphiques de première commande
Le graphique de [a] vs t des réactions de premier ordre est des hyperbolas descendant. Cependant, si le logarithme népérien.
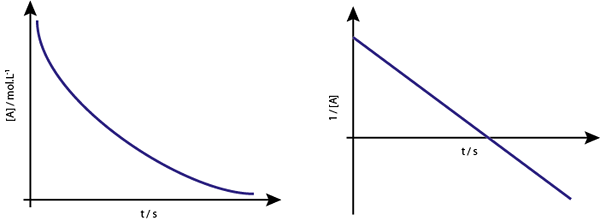 Le graphique de concentration par rapport au temps d'une réaction de l'ordre 1 donne une hyperbola, mais le graphique du logarithme népérienne de la concentration vs temps donne une ligne
Le graphique de concentration par rapport au temps d'une réaction de l'ordre 1 donne une hyperbola, mais le graphique du logarithme népérienne de la concentration vs temps donne une ligne Vie intermédiaire pour les réactions de premier ordre
Pour une réaction de l'ordre 1, t1/2 Il ne dépend pas de la concentration initiale et est donné par:
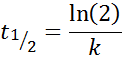
-
Réactions de second ordre
Une réaction peut être un second ordre en ce qui concerne un seul réactif, ou un premier ordre en ce qui concerne deux réactifs. Dans le premier cas, la loi de vitesse est donnée par:
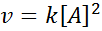
Graphiques de deuxième commande
Le graphique de [a] vs t des réactions de deuxième ordre est des hyperbolas descendant. Cependant, si l'inverse de la concentration (1 / [a]) vs temps est tracé, une ligne droite est obtenue.
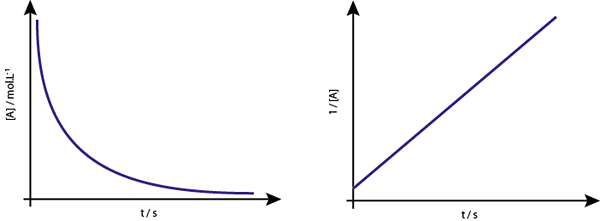 Le graphique de concentration par rapport au temps d'une réaction de l'ordre 2 donne une courbe similaire à une hyperbole descendante, mais le graphique de la concentration vs temps donne une ligne
Le graphique de concentration par rapport au temps d'une réaction de l'ordre 2 donne une courbe similaire à une hyperbole descendante, mais le graphique de la concentration vs temps donne une ligne Vie intermédiaire pour les réactions du second ordre
Pour une réaction de l'ordre 2, t1/2 Est donné par:
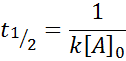
Facteurs qui affectent la vitesse de réaction
Température
La température augmente toujours la vitesse à laquelle les réactions se produisent, car la fréquence et l'énergie avec lesquelles les molécules entrent en collision. La dépendance à la vitesse de réaction avec la température est donnée par l'équation d'Arrhenius.
Il peut vous servir: Hydrure de magnésium: structure, propriétés et utilisationsPression
L'augmentation de la pression est équivalente à l'augmentation de la concentration de toutes les espèces dans le milieu de réaction (pour les réactions en phase gazeuse), donc les augmentations de pression ont tendance à augmenter la vitesse des réactions.
Catalyseurs
Les catalyseurs sont des substances chimiques qui sont ajoutées au milieu juste pour augmenter la vitesse de réaction. La plupart des catalyseurs travaillent en modifiant le mécanisme de réaction par celui qui nécessite une énergie d'activation plus faible.
Les exemples de catalyseur commun sont les enzymes dans les systèmes vivants et certains métaux tels que le platine et le paladium.
Inhibiteurs
Les inhibiteurs sont l'opposé des catalyseurs. Ce sont des substances qui font des réactions plus lentement. Les anticorrosives sont des exemples d'inhibiteurs qui cherchent à réduire la vitesse des réactions de corrosion, pour rendre plus de surfaces métalliques.


