Processus thermodynamiques
- 4535
- 880
- Noa Da silva
Nous expliquons quels sont les processus thermodynamiques, les types qui existent et donnent plusieurs exemples
Quels sont les processus thermodynamiques?
Les Processus thermodynamiques Ce sont des processus dans lesquels un système thermodynamique à l'étude subit un changement d'État. Pendant ce changement d'état, un mouvement d'énergie se produit soit dans le système ou entre le système et l'environnement. En fait, c'est la raison pour laquelle ils sont appelés Processus thermodynamiques, car thermos- Il se réfère à la chaleur (une forme d'énergie) et -dynamique Se réfère au mouvement.
Par changement d'état, il n'est pas nécessairement mentionné du solide au liquide ou du liquide gazier n'est pas réalisé (bien que ce soient également des processus thermodynamiques), mais à un changement de fonctions d'état, c'est-à-dire dans les variables qui définissent l'état de la état du système tel que la température, le volume et la pression.
Les processus thermodynamiques se produisent partout. En fait, pratiquement tout processus de changement pour lequel un système peut être défini peut être considéré comme un processus thermodynamique. D'une crème glacée fondant au fonctionnement d'un moteur à combustion interne ou au fonctionnement d'un mélangeur.
Types de processus thermodynamiques
Il existe une grande variété de processus thermodynamiques, il est donc nécessaire de les classer afin de faciliter leur étude. Les principaux critères pour classer les processus thermodynamiques sont:
- Selon le taux de change dans le système
- Selon la fonction d'état qui reste constante
- Selon la deuxième loi de la thermodynamique
1. Types de processus thermodynamiques en fonction du taux de change
-
Modifications du système
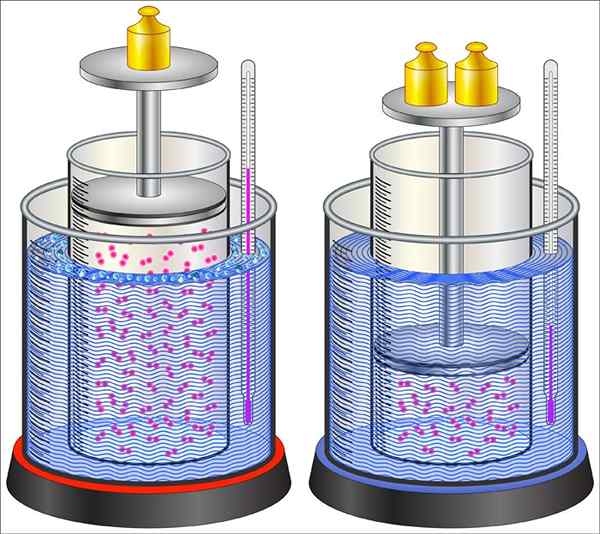
Ce type de processus thermodynamique est caractérisé par le passage du système d'un état initial à un dernier, tous deux définis par un nombre adéquat de variables d'état. Dans ce type de processus, le système est en équilibre thermodynamique à l'état initial et à l'état final et le changement est causé par un agent externe.
Peut vous servir: Petri Box: caractéristique, fonctions, utilisez des exemples Exemple du processus de changement dans le système, dans ce cas, un changement d'état se produit dans le gaz qui se trouve dans le cylindre
Exemple du processus de changement dans le système, dans ce cas, un changement d'état se produit dans le gaz qui se trouve dans le cylindre L'équilibre thermodynamique est une condition macroscopique, ce qui implique que le système ne subira aucun changement dans le temps à moins qu'il ne soit perturbé par une force externe. Cela peut consister en la contribution de l'énergie sous forme de chaleur, de travail, entre autres.
Il convient de noter que, lors de l'étude des processus de changement dans le système, plusieurs fois (mais pas toujours), le processus lui-même n'est pas importante mais seulement l'état initial et l'état final.
-
Processus cycliques
Dans de nombreuses situations, en particulier dans la construction de machines basées sur des processus thermodynamiques, le système est soumis à un ensemble de processus de changement d'état qui commencent à partir d'un état initial, passent à travers un ensemble d'états intermédiaires et se terminent à nouveau dans le même état initial d'origine, ainsi terminer un cycle.
 Les processus dans le cylindre d'un moteur à combustion interne sont des processus cycliques, qui sont continuellement répétés pour maintenir le moteur en marche
Les processus dans le cylindre d'un moteur à combustion interne sont des processus cycliques, qui sont continuellement répétés pour maintenir le moteur en marche Les processus cycliques ne produisent pas de changement net dans l'état du système (puisqu'ils commencent et se terminent dans le même état), mais selon la façon dont le cycle est effectué, ils peuvent produire le transfert d'énergie net d'une partie de l'environnement à un autre ou entre deux autres systèmes séparés.
Un exemple de processus cycliques est ce qui se passe dans les pistons d'un moteur à combustion interne, ainsi que l'ensemble des processus qui se produisent dans le compresseur des systèmes de refroidissement.
-
Procédés de flux
Les processus d'écoulement diffèrent des deux autres types de processus, dans lesquels le système est composé de la question qui se trouve à un moment donné dans un conteneur à travers lequel un flux constant de matière passe.
Peut vous servir: éthylène glycol: propriétés, structure chimique, utilisations Tuyaux dans une usine dans laquelle se produisent les processus de débit
Tuyaux dans une usine dans laquelle se produisent les processus de débit Ces types de processus thermodynamiques sont couramment utilisés dans l'ingénierie, et les propriétés d'intérêt sont, en général, les taux d'entrée et de sortie d'énergie vers et depuis le conteneur tel qu'il est traversé par la question qui peut être un liquide pur, une solution, un Mélange de réactifs, etc.
2. Types de processus thermodynamiques en fonction de la fonction d'état qui reste constante
Pour faciliter leur analyse et leur interprétation, de nombreux processus thermodynamiques sont effectués en maintenant une ou plusieurs variables constantes. De cette façon, les effets sur le système de changement d'un petit nombre de variables peuvent être déterminés. Cela fait que différents types de systèmes thermodynamiques peuvent être définis selon lesquels la variable reste constante. Ceux-ci sont:
-
Processus isothermes (t = CTTE)
Sont ces processus dans lesquels la température reste constante. Malgré le non semble intuitif, le fait que la température ne change pas ne signifie pas qu'il n'y a pas de transfert de chaleur. Au cours de ces processus, il n'y a aucun changement dans l'énergie interne du système.
-
Processus isocoriques (v = CTTE)
Sont les processus qui se produisent sans changement de volume. En général, ils se produisent dans des systèmes fermés avec des murs rigides (qui ne peuvent pas être déformés). Ils sont également appelés isovolumétriques et isométriques. Ils se caractérisent par n'impliquant pas le travail d'extension p-v.
-
Processus isobariques (p = ctte)
C'est peut-être le type de processus thermodynamique le plus courant avec lequel nous avons rencontré notre vie quotidienne. Ils sont caractérisés par une pression constante.
-
Processus adiabatiques (q = 0)
Ce sont les processus qui se produisent sans aucun transfert de chaleur. Ils sont généralement confondus avec les processus isothermes car, car il n'y a pas de transfert de chaleur, beaucoup supposent qu'il n'y a pas de changement de température. Cependant, ce n'est pas le cas.
-
Processus isoentropiques (S = CTTE)
Ce sont des processus dans lesquels l'entropie du système reste constante.
-
Processus isoentalpic (h = CTTE)
Ce sont les processus dans lesquels l'enthalpie du système reste constante.
Peut vous servir: thiosulfate de sodium (NA2S2O3)3. Types de processus thermodynamiques selon la deuxième loi de la thermodynamique
La deuxième loi est utilisée pour prédire la spontanéité des processus thermodynamiques. Sur la base de cela, les types de processus suivants peuvent être distingués:
-
Processus spontanés
Ce sont ceux qui impliquent une augmentation de l'entropie de l'univers et, par conséquent, se produisent spontanément (naturellement).
-
Processus réversibles
Ce type de processus n'implique pas de changement dans l'entropie de l'univers et, par conséquent, est en équilibre. Ce sont des processus réversibles qui peuvent se produire dans les deux sens.
-
Processus irréversibles
Ce sont ceux qui impliquent une diminution de l'entropie de l'univers et, par conséquent, ne se produisent pas naturellement de l'état initial à la fin, mais dans la direction opposée.
Exemples de processus thermodynamiques
- Le cycle de Carnot est un Processus cyclique de 4 étapes, sur lesquelles des systèmes de réfrigération tels que les références sont basés.
- L'évaporation d'une flaque d'eau est un exemple de processus thermodynamique irréversible.
- La formation de gel dans un congélateur est un Processus irréversible.
- Le refroidissement d'un gaz sous pression en le laissant échapper à la bouteille est un exemple de processus approximativement adiabatique.
- La combustion du gaz de cuisine se produit dans l'air à une pression atmosphérique constante, il est donc considéré comme un processus isobare.
- Le chauffage de l'eau dans un radiateur à gaz est un Processus de flux, Puisque l'eau entre et quitte le tuyau à un rythme constant, tout en absorbant la chaleur de la combustion de gaz.

