Caractéristiques, applications et exemples de processus politiques

- 1095
- 215
- Adrien Remy
UN Processus politique C'est un processus thermodynamique qui se produit lorsque la relation entre la pression P et le volume V donné par P.Vn Il reste constant. L'exposant n C'est un nombre réel, généralement entre zéro et infinité, mais que dans certains cas peut être négatif.
La valeur de n recevoir le nom de Indice de politique Et il est important de souligner que lors d'un processus thermodynamique polytropique, cet indice doit maintenir une valeur fixe, sinon le processus ne sera pas considéré.
 Figure 1. Équation caractéristique d'un processus thermodynamique polytropique. Source: F. Zapata.
Figure 1. Équation caractéristique d'un processus thermodynamique polytropique. Source: F. Zapata. [TOC]
Caractéristiques des processus polytropiques
Certains cas caractéristiques de processus polytropiques sont:
- Le processus isotherme (à température t constante), dans lequel l'exposant est n = 1.
- Un processus isobare (pression constante p), dans ce cas n = 0.
- Le processus isocorique (à la constante de volume V), pour lequel n = + ∞.
- Processus adiabatiques (à l'entropie constante), dans laquelle l'exposant est n = γ, étant γ la constante adiabatique. Cette constante est le quotient entre la capacité thermique à une pression constante CP divisée par la capacité thermique à un volume CV constant:
γ = CP / CV
- Tout autre processus thermodynamique qui n'est aucun des cas précédents. Mais respecter P.Vn = CTTE Avec un indice polytropique réel et constant n Ce sera également un processus polytropique.
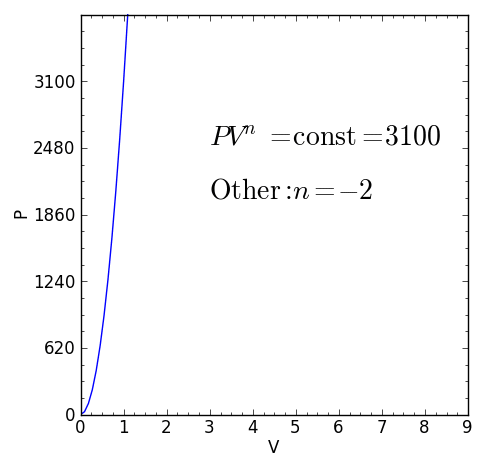 Figure 2. Différents cas caractéristiques de processus thermodynamiques polytropiques. Source: Wikimedia Commons.
Figure 2. Différents cas caractéristiques de processus thermodynamiques polytropiques. Source: Wikimedia Commons. Applications
L'une des principales applications de l'équation polytropique est le calcul des travaux effectués par un système thermodynamique fermé, lorsqu'il passe d'un état initial à une autre extrémité d'une manière quasi-statique, c'est-à-dire après une succession d'états d'équilibre.
Travailler dans des processus polytropiques pour différentes valeurs de n
Pour n ≠ 1
Le travail mécanique W effectué par un système thermodynamique fermé est calculé par expression:
W = ∫p.Dv
Peut vous servir: diamagnétisme: matériaux, applications, exemplesOù p est la pression et v le volume.
Comme dans le cas d'un processus polytropique, la relation entre la pression et le volume est:
P.V n = constant = c
Effacer p de l'expression précédente pour le remplacer dans l'expression du travail:
P = c /V n
Vous avez le travail mécanique effectué lors d'un processus polytropique, qui commence dans un état initial 1 et se termine dans l'état final 2. Tout cela apparaît dans l'expression suivante:

\left&space;[V_2^1-n-V_1^1-n&space;\right&space;])
C = p1 V1n = P2 V2n
En remplaçant la valeur de la constante dans l'expression du travail est obtenue:
W = (p2 V2 - P1 V1) / (1-n)
Dans le cas où la substance de travail peut être modélisée comme un gaz idéal, l'équation d'état suivante est:
P.V = m.R.T
Où m est le nombre de moles de gaz idéal et R est la constante universelle des gaz.
Pour un gaz idéal qui suit un processus polytropique avec un indice de polytropie différent de l'unité et qui passe d'un état avec une température initiale t1 à un autre état avec la température t2 Le travail effectué est donné par la formule suivante:
W = m r (t2 - T1) / (1-n)
Pour n → ∞
Selon la formule des travaux obtenus dans la section précédente, le travail d'un processus polytropique avec n = ∞ est nul, car l'expression du travail est divisée entre l'infini et donc le résultat tend à zéro.
Une autre façon d'atteindre ce résultat est de partir de la relation P1 V1n = P2 V2n, qui peut être réécrit comme suit:
(P1/ P2) = (V2/ V1)n
Prendre la racine N-détroise dans chaque membre que vous obtenez:
(V2/ V1) = (p1/ P2)(1 / n)
Dans le cas que n → ∞, vous devez (v2/ V1) = 1, ce qui signifie que:
Peut vous servir: Cédé chaleur: formules, comment la calculer et résoudre des exercicesV2 = V1
C'est-à-dire que le volume ne change pas dans un processus polytropique avec n → ∞. Par conséquent, le différentiel de volume DV dans l'intégrale du travail mécanique est 0. Ces types de processus polytropiques sont également appelés processus isocoric, o Processus à un volume constant.
Pour n = 1
Encore une fois, nous avons l'expression du travail:
W = ∫p dv
Dans le cas d'un processus polytropique avec n = 1, la relation entre la pression et le volume est:
P v = constante = c
En nettoyant P de l'expression précédente et en remplaçant, vous avez le travail pour passer de l'état initial 1 à l'état final 2:

C'est-à-dire:
W = c ln (v2/ V1).
Comme les états initiaux et finaux sont bien déterminés, le CTTE aussi. C'est-à-dire:
C = p1 V1 = P2 V2
Enfin, les expressions utiles suivantes sont disponibles pour trouver le travail mécanique d'un système fermé polyitropique dans lequel n = 1.
W = p1 V1 LN (V2/ V1) = P2 V2 LN (V2/ V1)
Si la substance de travail se compose de m Mules de gaz idéal, alors l'équation de gaz idéale peut être appliquée: P V = M.R.T.
Dans ce cas, comme P.V1 = CTTE, un processus polytropique avec n = 1 est un processus à température t constante (isotherme), de sorte que les expressions de travail suivantes peuvent être obtenues:
W = m r t1 LN (V2/ V1) = m r t2 LN (V2/ V1)
 figure 3. Une fusion du caramban, exemple de processus isotherme. Source: Pixabay.
figure 3. Une fusion du caramban, exemple de processus isotherme. Source: Pixabay. Exemples de processus polytropiques
- Exemple 1
Supposons un cylindre avec un piston mobile plein avec un kilogramme d'air. Initialement, l'air occupe un volume V1= 0,2 m3 à une pression p1= 400 kPa. Un processus polytropique est suivi avec n = γ = 1,4, dont l'état final a la pression p2 = 100 kPa. Déterminez le travail effectué par l'air sur le piston.
Solution
Lorsque l'indice de polytropie est égal à la constante adiabatique, il y a un processus dans lequel la substance de travail (air) n'échange pas de chaleur avec l'environnement et ne change donc pas l'entropie.
Il peut vous servir: troisième loi de la thermodynamique: formules, équations, exemplesPour l'air, un gaz diatomique idéal, vous avez:
γ = cp / cv, avec cp = (7/2) r et cv = (5/2) r
Ensuite:
γ = 7/5 = 1,4
En utilisant l'expression du processus polytropique, le volume final de l'air peut être déterminé:
V2 = [P2 V11.4) / P2]](1/1,4) = 0,54 m3.
Maintenant, il y a des conditions pour appliquer la formule de travail effectuée dans un processus polytropique pour n ≠ 1 obtenu ci-dessus:
W = (p2 V2 - P1 v1) / (1-n)
Le remplacement des valeurs appropriées est:
W = (100 kpa 0,54 m3 - 400 kpa 0,2 m3) / (1 - 1,4) = 65,4 kJ
- Exemple 2
Supposons le même cylindre de l'exemple 1, avec un piston mobile plein d'un kilogramme d'air. Initialement, l'air occupe un volume v1 = 0,2 m3 à une pression P1 = 400 kPa. Mais contrairement au cas précédent, l'air se dilate isothermiquement pour atteindre une pression finale P2 = 100 kPa. Déterminez le travail effectué par l'air sur le piston.
Solution
Comme indiqué précédemment, les processus isothermes sont des processus polytropiques avec l'index n = 1, il est donc réalisé que:
P1 V1 = P2 V2
De cette façon, le volume final peut être facilement détaché pour obtenir:
V2 = 0,8 m3
Ensuite, en utilisant l'expression des travaux précédemment obtenus pour le cas n = 1, vous devez travailler par l'air sur le piston dans ce processus est:
W = p1 v1 ln (v2 / v1) = 400000 pa × 0,2 m3 LN (0,8 / 0,2) = 110,9 kJ.
Les références
- Bauer, w. 2011. Physique pour l'ingénierie et les sciences. Volume 1. Mc Graw Hill.
- Cengel, et. 2012. Thermodynamique. 7e édition. McGraw Hill.
- Figueroa, D. (2005). Série: Physique pour la science et l'ingénierie. Volume 4. Fluides et thermodynamique. Édité par Douglas Figueroa (USB).
- López, C. La première loi de la thermodynamique. Récupéré de: Culturacientifica.com.
- Chevalier, r. 2017. Physique pour les scientifiques et l'ingénierie: une approche stratégique. Pearson.
- SERAY, R., Vulle, c. 2011. Fondamentaux de la physique. 9na ed. Cengage Learning.
- Université de Séville. Machines thermiques. Récupéré de: Laplace.nous.est.
- Wikiwand. Processus politique. Récupéré de: wikiwand.com.
- « Étude de recherche ce que sont, les types et les exemples
- Délimitation du sujet de recherche ce qui consiste et exemples »

