Structure de pyridine, propriétés, utilisations, toxicité, synthèse
- 5006
- 55
- Eva Henry
La Pyridine C'est une amine aromatique dont la formule chimique est c5H5N. C'est la version azote du benzène, car un groupe -ch = a été remplacé par un atome d'azote (n). Avec le pyrol, la pyridine forme le groupe d'amines aromatiques plus simples de tous.
Initialement, la pyridine s'est produite à partir du goudron de Hulla, mais c'était une petite méthode de performance. Cela a conduit à la création de plusieurs méthodes pour sa synthèse chimique, ce qui prévoit celui dans lequel la réaction du formaldéhyde, de l'acétaldéhyde et de l'ammoniac est utilisée.
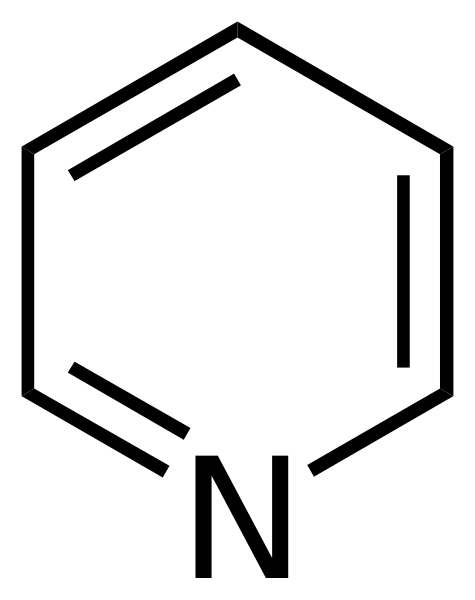 Formule structurelle de la pyridine. Source: Calvero. / Domaine public
Formule structurelle de la pyridine. Source: Calvero. / Domaine public La pyridine a été obtenue pour la première fois par Thomas Anderson (1843), un chimiste escoss, qui, par le chauffage des viandes et des os animaux, a produit une huile à partir de laquelle la pyridine a été purifiée.
 Thomas Anderson (juillet 1819)
Thomas Anderson (juillet 1819) La pyridine est utilisée comme matière première pour la synthèse de composés qui éliminent et contrôlent la prolifération des insectes, des champignons, des herbes, etc. Il est également utilisé dans l'élaboration de nombreux médicaments et vitamines, en plus d'être utilisé comme solvant.
La pyridine est un composé toxique qui peut de manière chronique endommager le foie, les reins et le fonctionnement du système nerveux central. La pyridine peut entrer dans le corps en raison de l'ingestion, de l'inhalation et de la diffusion à travers la peau. Il est connu dans le produit chimique car il s'agit d'une substance capable de provoquer une impuissance chez les hommes.
[TOC]
Structure de pyridine
Moléculaire
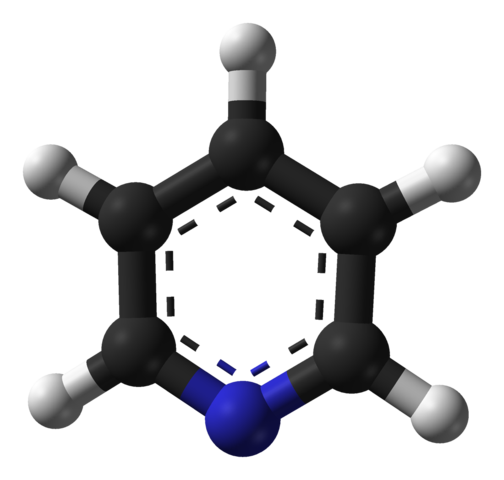 Structure moléculaire de la pyridine. Source: Benjah-Bmm27 / Domaine public
Structure moléculaire de la pyridine. Source: Benjah-Bmm27 / Domaine public L'image supérieure montre la structure moléculaire de la pyridine représentée par un modèle de sphères et de barres. Comme on peut le voir, sa molécule est très similaire à celle du benzène, avec la seule différence qu'il a un de ses carbones (sphères noires) remplacées par de l'azote (sphère bleue).
L'azote, car il est plus électronégatif, attire la densité électronique vers lui-même, ce qui crée un moment dipolaire permanent dans la pyridine. Par conséquent, les molécules de pyridine interagissent par les forces dipol-dipolo.
Les atomes d'hydrogène sont les régions les plus pauvres des électrons, de sorte qu'elles seront orientées dans le sens de l'atome d'azote d'une molécule voisine.
Cristalline
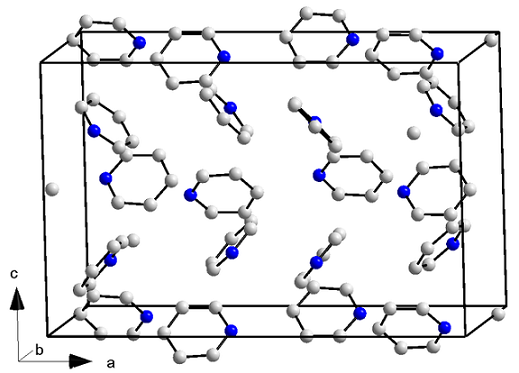
 Structure cristalline de la pyridine. Source: ORCI / CC BY-S (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Structure cristalline de la pyridine. Source: ORCI / CC BY-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) Les molécules de pyridine ont non seulement des forces dipol-dipolo, mais aussi avec des interactions des anneaux aromatiques. Ainsi, ces molécules parviennent à se positionner dans de manière ordonnée pour provoquer un cristal de structure ortorrombique (image supérieure) à une température de -41,6 ° C.
Propriétés de la pyridine
 Échantillon de pyridine. Lhchem / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Échantillon de pyridine. Lhchem / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0) Apparence physique
Liquide incolore, avec une odeur pénétrante, similaire à celle du poisson.
Peut vous servir: Méthode d'équilibre redox: étapes, exemples, exercicesMasse molaire
79.1 g / mol
Densité
0,9819 g / ml
Point de fusion
-41,6 ºC
Point d'ébullition
115,2 ºC
Solubilité
Il est miscible avec l'eau, ainsi que l'alcool, l'éther, l'éther d'huile, les huiles et de nombreux liquides biologiques en général.
La pression de vapeur
16 mmHg à 20 ºC.
Densité de vapeur
2,72 par rapport à l'eau = 1
Indice de réfraction (nD)
1 5093
Gelée
0,88 CP
Moment dipolaire
2,2 D
point d'allumage
21 ºC
Température d'auto-direction
482 ºC
Décomposition
Lorsqu'il est chauffé à la décomposition émet une fumée de cyanure.
Corrosion
La pyridine sous forme liquide attaque certaines formes de plastiques, de caoutchoucs et de revêtements.
pH
8,5 (solution 0,2 m dans l'eau)
Basicité et réactivité
La pyridine est une base faible. C'est une amine tertiaire dont la solution de 0,2 m dans l'eau produit un pH de 8,5. Il a peu d'affinité pour les électrons en raison de l'électronégativité à l'azote, donc leurs carbones ne subissent généralement pas de substitution électrophile.
La pyridine subit une substitution nucléophile, de préférence dans les positions c4 et C2 De l'anneau. En raison de sa capacité à donner des électrons, la pyridine est plus oxydation plus que le benzène et réagit violemment avec l'acide sulfurique, l'acide nitrique et l'anhydride Maleico.
Utilisations de la pyridine
Pesticides
La pyridine est un précurseur d'herbicide avant et diquat. De la même manière, il sert à la synthèse de l'insecticide chlorpirifos, dont l'étape initiale est la chloration de la pyridine. C'est également la matière première initiale pour obtenir le fongicide en fonction de la pyrition.
Solvant
La pyridine est un solvant polaire, utilisé pour les réactions des concessionnaires et l'extraction d'antibiotiques. La pyridine est utilisée comme solvant dans les industries de la peinture et du caoutchouc, ainsi que dans les laboratoires de recherche comme solvant dans l'extraction des hormones végétales.
Médecine
La pyridine sert de point initial dans la synthèse de Cetilpyridinium et de Laurilpyridinium, des composés utilisés comme antiseptiques dans les produits de soins oraux et dentaires. La molécule de pyridine fait partie de la structure chimique de nombreux médicaments.
Par exemple, l'esmeprazole, utilisé dans le traitement du reflux gastro-œsophagien. La loratidine est un autre médicament préparé sur la base de la pyridine, connue sous le nom de Claritin, qui est utilisée comme traitement des processus allergiques.
Les comprimés de pyridine (phénazopyridine) sont utilisés dans le traitement symptomatique d'une irritation des voies urinaires, qui s'accompagne, dans certains cas, de la douleur, de la brûlure et de l'urgence. La phénazopyridine est un colorant qui remplit une fonction analgésique dans les voies urinaires.
La di-acylhidrazine est un dérivé de pyridine qui a une activité antibactérienne qui exerce sur les bactéries à Gram négatif, telles que ET. coli, et des bactéries à Gram positif, comme S. Albus.
La pyridine sert de base à la thiazolo [5,4-6] pyridine, composée d'activité antivirale, en particulier contre le virus de la masse β de la grippe. La 2-acétylpyridine, un dérivé de pyridine, a une grande activité antitumorale et est un inhibiteur de leucémie.
Peut vous servir: oxyde de mercure (hg2o)Autres
La pyridine est utilisée dans la fabrication de vitamines, de produits en caoutchouc, d'adhésifs, de peintures et d'insecticides. Il est également utilisé dans la dénaturation de l'alcool et dans la coloration de certains textiles.
20% de la pyridine est utilisée dans la préparation de la pipéridine. La pipéridine intervient dans la vulcanisation et l'agriculture.
La pyridine est également utilisée dans la synthèse des résines polycarbonatées, comme saveur alimentaire et comme réactif pour la détection du cyanure.
Toxicité
- La pyridine entre dans l'organisme principalement en raison de l'inhalation et de la diffusion à travers la peau. Une exposition aiguë à la pyridine peut produire des irritations et des brûlures dans les yeux et la peau.
- La pyridine peut provenir de la dermatite et des allergies dans la peau. Le développement des allergies peut être accompagné en plus des démangeaisons et des téméraires.
- L'inhalation de pyridine peut provoquer une irritation du nez et de la gorge, accompagnée de toux et d'une respiration respiratoire asthmatique.
- Par ingestion, la pyridine peut provoquer des nausées, des vomissements, de la diarrhée et des douleurs abdominales. De même, l'incorporation d'une dose élevée de pyridine dans l'organisme peut provoquer: maux de tête, fatigue, décoloration, étonnant, étourdissements, confusion et finalement manger et mort.
- Les organes les plus touchés par l'action de la pyridine sont le foie, les reins, les organes génitaux masculins et le système nerveux central. Il peut également agir sur la moelle osseuse, induisant la production de plaquettes sanguines. Une action cancérigène de la pyridine n'a pas été mise en évidence chez les animaux.
L'OSHA a établi une exposition dans l'air de 5 ppm pour 8 heures de travail.
La synthèse
Les premières méthodes d'obtention de la pyridine étaient basées sur son extraction de matériaux organiques. Thomas Anderson (1843) a obtenu pour la première fois la pyridine en chauffant les viandes et les os d'animaux. Dans une première étape, Anderson a produit une huile à partir de laquelle il a réussi à distiller la pyridine.
Traditionnellement, la pyridine a été obtenue à partir de la gazéification du goudron ou du charbon Hulla. Ces procédures étaient lourdes et de peu de performances, car la concentration de pyridine dans ces matières premières était très faible. Une méthode de synthèse était nécessaire.
Méthode de chichibabine
Bien qu'il existe de nombreuses méthodes de synthèse de pyridine, la procédure de chichibabine introduite en 1923 est toujours utilisée principalement. Dans cette méthode, la pyridine est synthétisée à partir de la réaction du formaldéhyde, de l'acétaldéhyde et de l'ammoniac, qui sont des réactifs bon marché.
Peut vous servir: type de lien de 02Dans la première étape, le formaldéhyde et l'acétaldéhyde réagissent pour former le composé de l'acroléine, dans une réaction de condensation de Knoevegel, formant également de l'eau.
 Condensation de pyridine de l'acroleína et de l'acétaldéhyde
Condensation de pyridine de l'acroleína et de l'acétaldéhyde Enfin, dans une deuxième étape, Acroleína réagit avec le formaldéhyde et l'ammoniac pour former la dihydropyridine. Par la suite, la dihydropyridine est oxydée à la pyridine dans une réaction à 350 à 550 ° C en présence d'un catalyseur solide, par exemple, de la silice-alumine.
Réactions
Substitutions électrophyliques
Ces substitutions ne se produisent généralement pas en raison d'une faible densité électronique de pyridine.
La sulfanation présente une plus grande difficulté que la nitration. Mais la bromation et la chloration se produisent plus facilement.
Pyridine-n-oxyde
Le site d'oxydation de la pyridine est l'atome d'azote, étant l'oxydation produite par les pêches (acides qui ont un groupe OOH). L'oxydation de l'azote favorise la substitution électrophile dans les carbones 2 et 4 de la pyridine.
Substitutions nucléophiles
La pyridine peut connaître plusieurs substitutions nucléophiles en raison de la faible densité électronique des carbones de l'anneau de pyridine. Ces substitutions se produisent plus facilement dans la molécule de pyridine modifiée par le brome, le chlore, le fluor ou l'acide sulfonique.
Les composés effectués par des attaques nucléophiles contre la pyridine sont généralement: alcoxydes, tyolates, amines et ammoniac.
Réactions radicales
La pyridine peut être diminue par des réactions radicales. La dimérisation radicale de la pyridine est réalisée avec du sodium élémentaire ou du nickel Raney, en mesure de produire 4,4'-bipperdine ou 2.2'-bipperdine.
Réaction sur l'atome d'azote
Selon Lewis, les acides sont facilement ajoutés à l'atome d'azote de la pyridine, formant des sels de pyridine. La pyridine est une base de Lewis qui fait don de quelques électrons.
Réaction d'hydrogénation et de réduction
La pipéridine est produite par l'hydrogénation de la pyridine avec du nickel, du cobalt ou du ruthénium. Cette réaction est faite à des températures élevées accompagnées de l'utilisation d'un catalyseur.
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-wesley iberoamericana.
- Wikipédia. (2020). Pyridine. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2020). Pyridine. Base de données PubChem., CID = 1049. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Laura s'oppose. (2020). Pyridine: structure, formule et propriétés physiques. Étude. Récupéré de: étudier.com
- Atof Ali Altaf, Adnan Shahzad, Zarif Gul, Nasir Rasool, Amin Badshah, Bhajan Lal, Ezzat Khan. (2015). Une revue sur l'importance médicinale des dérivés de pyridine. Journal de conception de médicaments et de chimie médicinale. Vol. 1, non. 1, pp. 1-11. Doi: 10.11648 / j.Jddmc.20150101.onze
- Webmd. (2020). Comprimé de pyridine. Récupéré de: webmd.com
- Département de la santé et des services aux personnes âgées du New Jersey. (2002). Pyridine. [PDF]. Récupéré de: NJ.Gouvernement
- « Historique C ++, caractéristiques, types de données, exemples
- Fonctions essentielles des acides gras, importance, nomenclature, exemples »

