Structure du peroxyde d'hydrogène (H2O2), propriétés, utilisations, obtention

- 3337
- 399
- Prof Ines Gaillard
Il du peroxyde d'hydrogène C'est un composé inorganique dont la formule chimique est H2SOIT2. Tout le monde est le peroxyde le plus simple de cette famille de composés chimiques. Sa formule structurelle est H-O-O-H, ce pont oxygéné interne étant caractéristique pour tous les peroxydes.
En 1818, h2SOIT2 Il a été identifié par Louies Jacques Thénard, qui a préparé un composé chimique qu'il a demandé Huzigenada. C'est un composé instable, se décompose par exposition à la lumière, à la chaleur et à certains métaux.
 Formule chimique du peroxyde d'hydrogène
Formule chimique du peroxyde d'hydrogène C'est un composé très utile qui est utilisé dans la désinfection des blessures mineures, le blanchiment des cheveux, le traitement de l'eau, etc. Bien qu'il puisse avoir des actions nocives pour l'être humain, il se trouve dans toutes les cellules eucaryotes des êtres vivants, où il remplit plusieurs fonctions bénéfiques.
Le peroxyde d'hydrogène produit l'oxydation de substances toxiques telles que les phénols, l'éthanol, le formaldéhyde, etc., produits qui sont éliminés par le foie et les reins. De plus, il contribue à la destruction des bactéries phagocytées par les neutrophiles et les leucocytes des macrophages.
[TOC]
Structure
Molécule
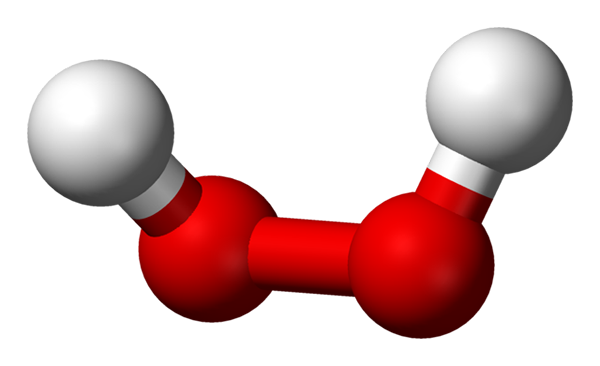 Molécule de peroxyde d'hydrogène représentée avec un modèle de sphères et de barres. Source: Benjah-Bmm27 via Wikipedia.
Molécule de peroxyde d'hydrogène représentée avec un modèle de sphères et de barres. Source: Benjah-Bmm27 via Wikipedia. Dans l'image supérieure, la structure de la molécule H peut être vue2SOIT2 (H-O-O-H), avec les sphères rouges correspondant aux atomes d'oxygène et aux atomes d'hydrogène blancs. Notez que la molécule n'est pas plate et que ni les atomes H ne sont éclipsés dans l'espace (l'un devant l'autre).
Fait intéressant, à H2SOIT2 Il est difficile de faire pivoter son simple lien central O-O, de sorte que les positions de ces H ne peuvent pas être échangées; L'un ne tombera pas pendant que l'autre monte.
Parce que? Parce que dans les deux atomes d'oxygène, il y a deux paires sans électrons, ce qui donne un total de huit électrons très proches et qui se repousse pour leurs charges négatives.
Rotations
Même ainsi, le lien O-O est susceptible de tourner en raison des interactions avec son environnement.
Par exemple, lorsqu'il est avec les deux pouces, les doigts étendus et les autres ont fermé, comme tracer un tribunal, puis tourner les pouces de telle manière que l'un des doigts cible et l'autre en arrière, il y aura un Représentation approximative de H2SOIT2.
Si un corps joue l'un des indices, les pouces tourneront en réponse à cette interaction; Cependant, ils reviendront immédiatement à leur position d'origine en raison des répulsions électroniques mentionnées ci-dessus. Ces rotations encadrent les aspects dynamiques de cette molécule.
Interactions intermoléculaires
Dans l'état liquide, le H2SOIT2 parvient à établir des ponts d'hydrogène (hooh-o2H2), sinon son point d'ébullition élevé (150 ºC) ne serait pas expliqué par rapport à l'eau.
Peut vous servir: sulfate de calcium (cas4): structure chimique, propriétés, utilisationsUne fois qu'il est passé à la phase gazeuse, les molécules M2SOIT2 Vraisemblablement ne peut plus former de tels ponts, non seulement à la plus grande distance intermoléculaire, mais aussi les atomes d'hydrogène seraient les premiers à être touchés en cas de collisions (cela peut être visualisé en recouvrant au modèle des doigts).
Entre-temps, en phase solide, l'angle des plans qui établissent le H est de 90 ° (mettre les doigts perpendiculaires)). Les ponts d'hydrogène deviennent maintenant encore plus importants et les molécules H2SOIT2 Ils sont ordonnés dans un cristal de structure tétragonale.
Propriétés
Sbotella avec peroxyde d'hydrogène. Dans les pharmacies, il est réalisé avec une concentration de 3% M / V. Source: pixnio.
Des noms
-Du peroxyde d'hydrogène
-Dioxidano
-Oxydanol
-Acide perhydoxique
-O-hydroxyol
-Eau oxygénée
Masse molaire
34 0147 g / mol
Apparence physique
Bleu pâle (concentré) ou incolore. Il est légèrement plus visqueux et dense que l'eau. Il est distillé pour la sécurité à basse température et à une pression réduite, car il se décompose en chauffant explosivement.
Odeur
Aigu ou une odeur similaire à l'ozone.
Saveur
Amer
Densité
Solide 1,71 g / cm3
Les densités de leurs solutions aqueuses dépendent de leur concentration; Par exemple, 27% ont une densité de 1,10 g / cm3, tandis que 50%, 1,13 g / cm3
Point de fusion
- 0,43 ºC
Point d'ébullition
150,2 ºC. Cette valeur a été obtenue par extrapolation, depuis que le peroxyde d'hydrogène se décompose à des températures élevées.
Solubilité dans l'eau
Discible ≥ 100 mg / ml à 25 ° C
Solubilité
Il est soluble dans l'éther et les alcools, mais insoluble dans l'éther d'huile. Il se décompose dans l'eau et l'oxygène dans de nombreux solvants organiques.
Coefficient de partition octanol / eau
Log p = - 0,43
La pression de vapeur
5 mmHg à 30 ºC.
Constante de dissociation
PKA = 11,72
pH
Les solutions de peroxyde d'hydrogène sont légèrement acides. Par exemple, un à 35% a un pH de 4,6; Mais lors de la concentration à 90%, le pH devient moins acide: 5.1.
Indice de réfraction (nD)
14061
Gelée
1 245 cpoise à 20 ° C.
Capacité thermique
1 267 J / g · k (gaz)
2 619 J / g · k (liquide)
Chaleur de vaporisation
1 519 J / g · k
La stabilité
Stable dans les conditions recommandées. L'ajout d'acétanylide et de sels d'étain le stabilise davantage.
Corrosion
Corrosif
Décomposition
Il se décompose par exposition à la lumière ou en présence de substances oxydantes et réducteurs. Il est également décomposé en réchauffant. Lorsqu'il est saisi, l'eau et l'oxygène sont libérés et favorisés par une augmentation du pH et de la température, ainsi qu'avec la présence de l'enzyme catlase.
Peut vous servir: peroxyde de sodium (NA2O2): structure, propriétés, utilisationsTension superficielle
80,4 Dins / cm A 20 ºC
Réactivité
Le H2SOIT2 Il agit comme un agent oxydant dans les solutions acides de fer ferreux (Faith2+) Fer ferrique (f3+)); oxyder également l'ion de sulfite (donc32-) à l'ion sulfate (donc42-).
Il peut également agir comme un agent réducteur en présence de solutions de base, en réduisant à l'hypochlorite de sodium (NaOCL) et au permanganate de potassium (KMNO4) Avec libération d'oxygène.
Applications
Blanchiment
Le peroxyde d'hydrogène est utilisé dans l'industrie du papier dans le blanchiment de la pulpe et du papier, qui consomme la majeure partie de sa production annuelle.
Désinfectant
Le peroxyde d'hydrogène est un antiseptique doux pour éviter les petites infections des plaies, les éraflures et les brûlures. Il est également utilisé comme rinçage de la bouche et pour soulager une légère irritation de la bouche en raison de la présence d'embouchis ou de gingivite.
Il est également utilisé pour désinfecter les surfaces, l'intérieur des réfrigérateurs, l'eau et combattre une croissance bactérienne excessive des systèmes d'eau et des tours de refroidissement. Le peroxyde d'hydrogène libère des radicaux sans oxygène, qui décomposent les polluants.
Détergent
Le peroxyde d'hydrogène est utilisé dans la fabrication de détergents blanchissants des vêtements, y compris le carbonate de sodium. Ce composé est un complexe de carbonate de sodium et de peroxyde d'hydrogène qui est dissous dans l'eau séparés dans ses composants.
Application cosmétique
Le peroxyde d'hydrogène dilué est utilisé dans le blanchiment des cheveux, avant la coloration. Il est également utilisé pour blanchir les dents, dans le cadre d'une crème dentaire maison.
Propergol
Le peroxyde d'hydrogène est utilisé comme composant monoporpellant ou oxydant d'une fusée bipropono. Il décompose en libérant de l'oxygène et de l'eau, une caractéristique qui a permis à son utilisation de propulseur.
Une cellule de réaction est pompée avec la présence d'un catalyseur qui accélère ladite décomposition. Pendant cela, la vapeur d'eau est produite à haute température.
Lorsque la vapeur est expulsée par un écart produit une impulsion. Le sous-marin V-80 construit en 1940, utilisé dans les turbines à oxygène générées à partir de peroxyde d'hydrogène; appelé Walter Turbine System.
Obtention
Initialement, le peroxyde d'hydrogène a été obtenu industriellement par hydrolyse du persulfate d'ammonium, [(NH4)2S2SOIT8] ou l'électrolyse du bisulfate d'ammonium, NH4HSO4.
Le peroxyde d'hydrogène est obtenu industriellement grâce à l'utilisation de l'antraquinone. Le processus est effectué en quatre étapes: hydrogénation, filtration, oxydation, extraction et purification.
Peut vous servir: fluorure de magnésium: structure, propriétés, synthèse, utilisationsHydrogénation
L'alquilantroquinona est hydrogéné en faisant passer l'hydrogène gazeux à travers un hydrogérateur chargé d'alumine et une petite quantité de catalyseur (paladium). La température est maintenue à 45 ºC avec une agitation permanente.
L'alkyndroquinone est convertie en alquiloantrahydroquinona et en tétrahydroalquilantrahydroquinone, en sélectionnant ce dernier pour sa plus grande commodité pour les procédures suivantes.
Filtration
La solution contenait.
Oxydation
La solution filtrée s'oxyde en passant de l'air à travers elle, formant un peroxyde d'hydrogène à faible pureté.
Extraction et purification
La solution avec du peroxyde d'hydrogène traverse une colonne d'extraction liquide-liquide. L'eau traverse la colonne, tandis que la solution avec du peroxyde d'hydrogène est pompée par elle.
L'eau atteint le fond de l'extracteur avec une concentration de peroxyde d'hydrogène entre 25 et 35% P / P. Ensuite, il est purifié par distillation sous vide, à une concentration de peroxyde d'hydrogène à 30%. Enfin stabilisé et stocké.
Des risques
 Brûlure du peroxyde d'hydrogène. Source: bobjgalindo [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Brûlure du peroxyde d'hydrogène. Source: bobjgalindo [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Le peroxyde d'hydrogène est un agent corrosif, de sorte que le contact cutané produit une irritation sévère, en plus du blanchiment temporaire (image supérieure). Il peut également produire des lésions oculaires, des démangeaisons, du salpain, des rougeurs et une formation d'ampoules.
Son inhalation produit une irritation dans le nez, la gorge et les poumons. Pendant ce temps, une exposition répétée peut provoquer une bronchite, une toux, un flegme et un raccourcissement respiratoire. Et comme si cela ne suffisait pas, il génère également des maux de tête, du vahid, des nausées et des vomissements.
Une exposition grave au peroxyde d'hydrogène peut produire une accumulation de liquide dans les poumons, qui est connue sous le nom d'œdème pulmonaire: état grave qui nécessite des soins médicaux rapides.
L'Administration de la sécurité et de la santé au travail (OSHA) a établi le maximum autorisé pour le peroxyde d'hydrogène de 1 ppm dans un environnement de travail dans une journée de 8 heures. Cependant, comme il s'agit d'un composé mutagène, l'exposition au minimum doit être réduite.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Peroxyde d'hydrogène. Récupéré de: dans.Wikipédia.org
- William R. Bus et Henri A. Prélèvement. (2004). Structure cristalline et moléculaire du peroxyde d'hydrogène: une étude de neutrons - diffraction. est ce que je.org / 10.1063/1.1696379
- Centre national d'information sur la biotechnologie. (2019). Peroxyde d'hydrogène. Base de données PubChem. CID = 784. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Les éditeurs d'Enyclopaedia Britannica. (27 novembre 2018). Peroxyde d'hydrogène. Encyclopædia Britannica. Récupéré de: Britannica.com
- Département de la santé du New Jersey. (2016). Peroxyde d'hydrogène. [PDF]. Récupéré de: NJ.Gouvernement
- Mathews, C. K., Van Holde, K. ET., Ahern, k. g. (2002). Biochimie. Troisième édition. Pearson Addison Wesley Editorial
- Web md. (2019). Peroxyde d'hydrogène. Récupéré de: webmd.com
- « Histoire de la médecine aztèque, Dieu, plantes, maladies
- Structure d'oxyde de zinc (ZnO), propriétés, utilisations, risques »

