Structure de pepsinogène, fonctions, types, synthèse
- 2012
- 338
- Justine Charpentier
Il Pepsinogène C'est le zimogène de la pepsine, l'une des principales enzymes hydrolytiques chargées de la digestion des protéines dans l'estomac des mammifères. Les zimogènes ou les proenzymes sont des précurseurs enzymatiques inactifs, c'est-à-dire qu'ils sont incapables de catalyser les réactions réalisées par leurs formes actives.
Son activation dépend des changements dans la structure à trois dimensions de la protéine qui donne naissance à la formation d'un site actif fonctionnel. Ces changements, dans la plupart des cas, coïncident avec la rupture protéolytique d'un segment protéique.
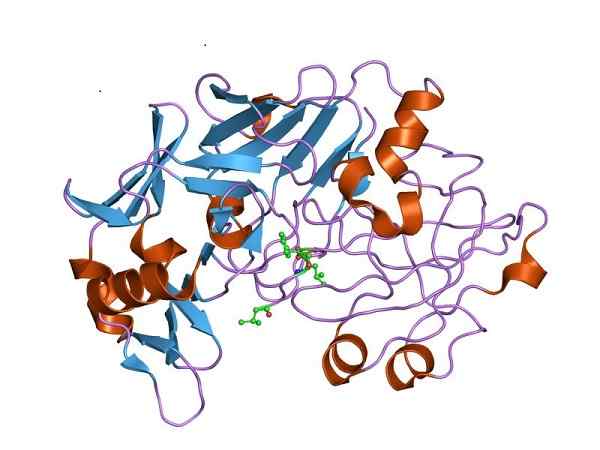
 Structure à trois dimensions de la pepsine, la forme catalytiquement active de la pepsinogène. Par Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domaine public (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons
Structure à trois dimensions de la pepsine, la forme catalytiquement active de la pepsinogène. Par Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domaine public (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons Par conséquent, le pepsinogène doit subir des changements structurels pour acquérir l'activité de la peptidase requise et favoriser la digestion des protéines dans l'estomac, après l'apport alimentaire.
[TOC]
Structure
Le pepsinogène est une protéine d'acide aminé 371 appartenant à la grande famille de protéinases aspartiques, caractérisée par la présentation de résidus d'acide aspartique dans son centre actif.
Sa structure quaternaire a été déterminée pour la première fois pour la protéine exprimée chez les porcs à travers la technique de cristallographie X-Ray. Le résultat était similaire à celui présenté par la forme mature ou active de la protéine, la pepsine.
Ainsi, la seule différence trouvée est la présence dans le pepsinogène d'un peptide d'acide aminé 44 qui se replie sur la fente du site actif. Dans cette position, il entrave l'interaction de cette protéase avec les protéines à dégrader.
Ce peptide qui sera clivé pour donner naissance à l'enzyme active, est située à l'extrémité terminale amino de la protéine.
Puisqu'il ne fonctionne que comme un capuchon, l'incapacité de la protéine de dégradation du pepsinogène n'est pas due aux déformations structurelles du centre actif. Au contraire, cela reste avec la même conformation dans les deux formes de l'enzyme.
Peut vous servir: Glucans: structure, caractéristiques et fonctionsEn ce sens, il convient de noter que la structure cristalline du pepsinogène constitue un modèle approximatif de la structure d'autres zimogenos appartenant à la grande famille de protéines aspartiques.
Les fonctions
Au début de la vie, la pepsine (forme active de pepsinogène) est importante pour la digestion du lait. Par la suite, sa fonction consiste à dégrader les protéines du régime dans leurs constituants (acides aminés) afin de faciliter leur absorption facile.
Synthèse et sécrétion
Le pepsinogène est synthétisé par les cellules principales et les cellules funtiques de la muqueuse gastrique. Par la suite, il est stocké dans des vésicules sécrétoires qui restent dans le cytoplasme de ces cellules jusqu'au moment où leur libération est requise.
Par conséquent, la sécrétion de ce zimogène est un processus réglementé. Sa libération de vésicules, résidents du cytosol par exocytose, nécessite des stimuli hormonaux et neuronaux. L'augmentation des niveaux d'enzymes gastriques sécrète et la gastrine, ainsi que l'acétylcholine, la cholécystoquinine, le facteur de croissance épidermique et l'oxyde nitrique stimulent leur synthèse et leur sécrétion.
De plus, des expériences menées avec des cellules ATT20, une lignée cellulaire couramment utilisée dans l'étude des routes de sécrétion chez les mammifères, ont montré qu'une augmentation de l'ampli cyclique est également capable d'induire une telle sécrétion.
En plus de sa sécrétion normale au niveau de l'estomac, une quantité relativement faible de pepsinogène a été détectée à la fois dans le sang et l'urine, c'est pourquoi elle a été appelée uroopepsinogène.
L'origine de l'uropepsinogène, ainsi que la fonction qu'il peut remplir à deux endroits, reste sans être déterminée. Cependant, leur absence chez les patients qui ont totalement retiré l'estomac semble indiquer que leur origine est également l'estomac.
Gars
Jusqu'à présent, deux principaux types de pepsinogène ont été décrits: le pepsinogène I et le pepsinogène II. Les deux types ne présentent pas de différences dans leur activité catalytique et sont également activés par l'hydrolyse protéolytique dépendant de l'acide chlorhydrique.
Peut vous servir: dénaturation des protéines: ce qui est, les facteurs, les conséquencesLe pepsinogène I est synthétisé et séparé par les cellules principales et par les cellules fondamentales de la muqueuse gastrique. Par conséquent, sa sécrétion diminue chez les patients atteints de gastrite chronique atrophique, une maladie de l'estomac caractérisée par la disparition totale des glandes gastriques.
Contrairement à ce dernier, Pepsinogen II (PGII) est synthétisé par pratiquement toutes les cellules qui font partie de la muqueuse gastrique, mais plus importante par celles de la muqueuse antrale et celles qui composent les glandes Brünner présentes dans le duodénuma.
Chez les patients atteints de gastrite chronique atrophique, ce type de pepsinogène compense la diminution de la sécrétion de pepsinogène I.
L'existence de ces deux types de pepsinogène, qui ne diffèrent qu'en étant sécrétée par différentes cellules, peut sembler redondante. Cependant, il peut s'agir d'une adaptation évolutive pour garantir la synthèse de la pepsine chaque fois que nécessaire.
Activation
Le pepsinogène acquiert une activité catalytique lorsqu'elle est transformée en pepsine, produit de l'élimination du 44 peptide d'acide aminé présent dans la cavité du site actif.
Son fonctionnement optimal dépend des valeurs de pH faibles incluses dans la plage de 1,5 à 2. Dans des conditions physiologiques, ces valeurs sont maintenues par la sécrétion d'acide chlorhydrique dans les canaux intracellulaires.
La digestion acide au niveau de l'estomac ne se produit pas chez tous les animaux, en être un exemple sont des insectes, qui manquent de pepsinogène. Cependant, les vertébrés qui ont un estomac s'ils ont une activité gastronomique.
Le pepsinogène, qui est stocké dans les vésicules sécrétoires des cellules principales, est libérée dans le canal gastrique si nécessaire. Une fois qu'il a atteint l'estomac, il devient le produit de la pepsine de l'environnement acide et de cette molécules plus pepsinogènes plus.
Par action des fibres nerveuses intrinsèques et une stimulation extrinsèque vagale, la production de pepsinogène est stimulée, ainsi que le HCl, la gastrine et l'histamine. D'un autre côté, l'histamine et la gastrine stimulent les cellules pariétales à sécréter HCl.
Peut vous servir: tissus conducteurs: ce qui est, les caractéristiques, les fonctionsLa pepsine, comme toutes les endopeptidase, agit sur des liens spécifiques entre les acides aminés protéiques pour générer des peptides plus petits.
En d'autres termes; Hydrolyse les liaisons peptidiques internes d'une protéine. Son action est plus efficace dans les liaisons peptidiques proches des acides aminés aromatiques (phénylalanine, tyrosine). Contrairement à son zimogène précurseur, les changements adaptatifs de la pepsine dans des valeurs de pH supérieurs à 6 produisent des déclins irréversibles de l'activité catalytique.
Les références
- Bryksa BC, Tanaka T, Yada RY. Modification N-terminale augmente la stabilité de la pepsine neutre. Biochimie. 2003; 42: 13331-13338.
- Foltmann B, Pedreson VB. Comparaison des structures primaires de la protection acide et de leurs zymogènes. Adv Exp Med Biol. 1977; 95: 3-22.
- Guyton A, Hall J. (2006). Manuel de phisiologie médicale. (11th ed.). USA: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S, Jameson J. (2005). Harrison, Principes de la médecine interne. (16 ed.). Mexique: McGrawhill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino MA. Gastrite atrophique sévère avec infection à Helicobacter pylori et cancer gastrique. Cancer de l'estomac. 1998; 1: 118-124.
- Lin Y, Found M, Lin X, Hartsuck JA, Tang J. Dépendance du pH des paramètres cinétiques de la pepsine, de la rhizopuspepsine et de leurs mutants de liaisons hydrogène de site actif. J Biol Chem. 1992; 267: 18413-18418.
- Mangeat p. Sécrétion d'acide et réorganisation de la membrane dans une seule cellule pariétale gastrique dans la culture primaire. Cellule de biologie. 1990; 69: 223-257.
- Prozialeck J, Wershil BK. (2017). Développement d'une fonction sécrétoire gastrique. Physiologie fœtale et néonatale (cinquième édition). Volume 1, pages 881-888.
- Schubert ML. Secret gastrique. Current Opin Gastroent 2005; 21: 633-757.
- Sielecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James Mng. Les structures moléculaires et cristallines de la pepsine porcine monoclinique affinée à 1.Résolution de 8 Å. J Mol Biol. 1990; 214: 143-170.
- Webb PM, Hengels KJ, Moller H, Newell DG, Palli D, Elder JB. L'épidémiologie des faibles niveaux de pepsinogène A sérum et une association internationale avec des taux de cancer gastrique. Gastro-entérologie. 1994; 107: 1335-1344.
- Wolfe MM, Soll Ah. La physiologie du secret de l'acide gastrique. N Anglais J Med 1998; 319: 1707.
- « Développement des cellules G, gastrine, canaux typosables de tourbe
- Caractéristiques Nanche, habitat, propriétés, recettes de cuisson »

