Structure chimique de Pencanona, propriétés, synthèse, utilisations
- 3491
- 720
- Noa Da silva
La Pentanona C'est un composé organique, appartenant à la famille des cétones, dont la formule chimique est C5HdixSOIT. Il reste l'une des cétones les plus simples et se compose d'un liquide incolore avec un arôme similaire à celui de l'acétone. À partir de là, en ce qui concerne le nombre de carbone de leur squelette, les cétones présentent une position de position.
Lorsque vous parlez de position, Isoméria fait référence à l'endroit où se trouve le groupe carbonyle, c = o. Ainsi, Puntanona se compose en fait de deux composés aux propriétés physiques qui diffèrent à peine les unes des autres: 2-penone et 3-penone (image inférieure). Les deux sont liquides, mais leurs points d'ébullition sont les mêmes, donc ils ne peuvent pas être séparés par distillation.
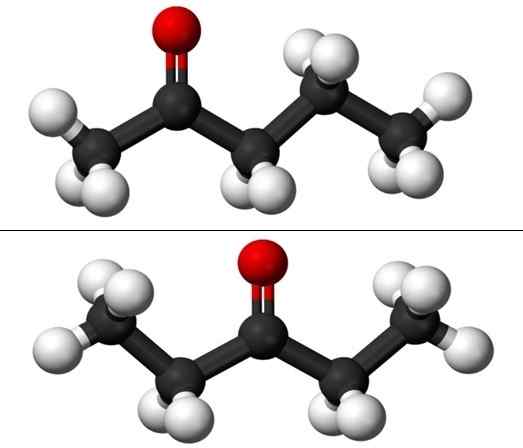
 Molécules de la position isomères pour pentanona. Source: Jynto et Ben Mills via Wikipedia.
Molécules de la position isomères pour pentanona. Source: Jynto et Ben Mills via Wikipedia. Cependant, chacun des deux pentanones a sa propre voie de synthèse, il est donc peu probable qu'il y ait un mélange d'entre eux; mélange qui peut être possible pour se séparer par congélation.
Ses utilisations sont restreintes en particulier en tant que solvants organiques; Alternatives à l'acétone dans les médias où vous travaillez avec une température supérieure à son faible point d'ébullition. Ils démarrent également des matériaux pour une autre synthèse organique, car leur groupe C = O peut réduire ou souffrir d'addition nucléophile.
[TOC]
Structure chimique
Positionner les isomères
Dans l'image, nous avons les structures moléculaires des deux isomères de position pour le Puntanona, représentés par un modèle de sphères et de barres. Les sphères noires correspondent à des squelettes gazéifiés, aux atomes blancs à hydrogène et aux atomes d'oxygène rouge dans le groupe c = o.
2-pintanone
Le 2-Ponanona (ci-dessus) a le groupe C = ou dans le deuxième carbone, ce qui équivaut à si elle était dans la pièce; c'est-à-dire que le 2-Ponanona et le 4-Pantanona sont équivalents, car il suffit de les faire pivoter à 180 ° afin que leurs structures soient les mêmes.
Peut vous servir: tétrachlorure de carbone (CCL4)À gauche de C = O vous avez un radical méthyle, CHO3-, Et à sa droite, une propuls radicale. C'est pourquoi cette Cetona reçoit également le nom (moins utilisé) de Metil propil Cetona (MPK en anglais). Vous pouvez voir l'asymétrie de cette structure à première vue.
3 pennes
Le 3-Péntanona (ci-dessous) a le groupe C = O dans le troisième carbone. Notez que cet isomère est une version plus grande de l'acétone et qu'elle est également très symétrique; Les deux radicaux sur les côtés du groupe C = O sont les mêmes: deux radicaux éthyliques, ch3Ch2-. C'est pourquoi le 3-Pananona est également appelé Cetona Diestil (ou diméthyl acétone).
Interactions intermoléculaires
La présence du groupe carbonyle, à la fois en 2-pantanone et dans la penona 3, confère la polarité à la molécule.
Par conséquent, les deux isomères de Pentanona sont capables d'interagir les uns avec les autres par le dipole-dipol.
De même, les forces de dispersion de Londres entre le carbone et les squelettes hydrogénés interviennent dans une moindre mesure.
En ayant le Puntanona, une plus grande zone moléculaire et masse par rapport à celles de l'acétone, cette contribution ajoute à son moment dipolaire et permet à un point d'ébullition plus élevé (102 ºC> 56 ºC) de posséder un point d'ébullition plus élevé). En fait, les deux isomères se vaporisent à 102 ºC; Pendant qu'ils gèlent à différentes températures.
Cristaux
Probablement en cristallisation, les symétries jouent-elles un rôle important. Par exemple, le point de fusion du 2 -Pantanona est de -78 ºC, tandis que le 3 -péntanona, -39 ºC.
Peut vous servir: loi avogadroCela signifie que les cristaux de 3-pantanona sont plus stables contre la température; Ses molécules sont plus cohésives et nécessitent plus de chaleur pour se séparer dans la phase liquide.
S'il y avait un mélange de deux isomères, le 3-penone serait le premier à cristalliser, étant enfin le 2-Pananona à une température plus basse. Les molécules du 3-pantanone, plus symétriques, sont orientées plus facilement que celles de 2-Ponanona: asymétrique et en même temps plus dynamique.
Propriétés
Apparence physique
Liquides incolores avec un arôme similaire à celui de l'acétone.
Masse molaire
86,13 g / mol
Densité
0,81 g / ml (3-Ponanona)
0,809 g / ml (2-Ponanona)
Point de fusion
-78 ºC (2-Ponanona)
-39 ºC (3-Ponanona)
Point d'ébullition
102 ºC (pour les deux isomères)
Solubilité dans l'eau
35 g / L (3-Ponenona)
60 g / L (2-Ponenona)
La pression de vapeur
35 MMHg (3-Ponenona)
270 mmHg (2-pantanone) à 20 ºC
Ces valeurs ne sont pas utiles pour comparer directement les pressions de vapeur des deux isomères, comme le premier est rapporté sans la température à laquelle il a été mesuré.
point de rupture
12,78 ºC (3-Ponanona)
10 ºC (2-Ponanona)
La stabilité
Les deux isomères Pentanona sont extrêmement inflammables, ils doivent donc rester aussi loin de toute source de chaleur. Les points flash indiquent qu'une flamme peut régler les vapeurs des deux pentanas même à une température de 10 ºC.
La synthèse
Bien que les deux isomères Pentanona soient physiquement et chimiquement très similaires, leurs routes synthétiques sont indépendantes de l'autre, il est donc peu probable que les deux soient obtenus dans la même synthèse.
2-pintanone
À partir du réactif 2-pénol, un alcool secondaire, cela peut être oxydé en 2-ponanone en utilisant de l'acide hypochloreux formé in situ, HCLO, en tant qu'agent oxydant. L'oxydation serait:
Il peut vous servir: pas d'électrolytes: caractéristiques et exemples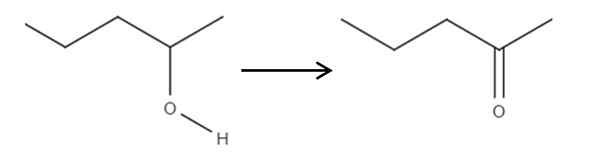 Oxydation du 2-pantanol à 2-pantanona. Source: Gabriel Bolívar.
Oxydation du 2-pantanol à 2-pantanona. Source: Gabriel Bolívar. Simplement le lien c-oh devient c = o. Il existe d'autres méthodes pour synthétiser le 2-penona, mais c'est le plus simple à comprendre.
3 pennes
Le 3-Pintanone peut être synthétisé par des moyens3Ch2COOH. Cette route synthétique produit des cétones symétriques, et c'est qu'une molécule CHO3COOH perdra le groupe COOH sous la forme de CO2, Tandis que l'autre votre groupe oh sous la forme de h2SOIT:
2ch3Ch2COOH => CH3Ch2Coch2Ch3 + CO2 + H2SOIT
Un autre itinéraire légèrement plus complexe consiste à réagir directement un mélange d'éthylène, Cho2= Ch2, CO2 et h2 Pour former le 3-Ponanona.
Applications
À moins que l'application ne soit très rigoureuse, c'est une synthèse spécifique, ou qu'il a également été démontré que les deux isomères ne provoquent pas les mêmes résultats, il n'est pas pertinent de choisir entre l'utilisation du 2-penone ou du 3-penone dans aucun de ses ses les usages.
Autrement dit, "cela n'a pas d'importance" si vous voulez utiliser le 2-Ponanona ou la 3-penona comme solvant de peintures ou de résines, ou comme misérable, car les critères les plus importants deviendront son prix et sa disponibilité. Le 3-penone est utilisé dans l'industrie automobile pour étudier le comportement des gaz à l'intérieur des moteurs à combustion interne.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- Wikipédia. (2019). 3 pain. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2019). 2-pontenone. Base de données PubChem. CID = 7895. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Société royale de chimie. (2019). 3 pain. Récupéré de: Chemspider.com
- Professeur t. Nalli. (2013). Oxydation du 2-pintanol et distillation du produit. Récupéré de: Cours1.Winona.Édu

