Caractéristiques des oxydorréductases, structure, fonctions, exemples
- 1441
- 412
- Adrien Remy
Le oxydorreductases Ce sont des protéines à activité enzymatique qui sont en charge des réactions de catalyse de réduction de la rouille, c'est-à-dire des réactions qui impliquent l'élimination des atomes d'hydrogène ou d'électrons dans les substrats sur lesquels ils agissent.
Les réactions catalysées par ces enzymes, comme son nom l'indique, sont des réactions de réduction de l'oxyde, c'est-à-dire des réactions où une molécule donne des électrons ou des atomes d'hydrogène et une autre les reçoit, changeant leurs états d'oxydation respectifs.
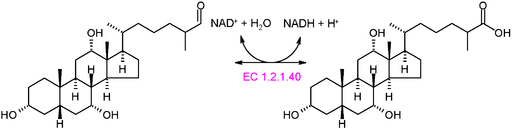 Schéma graphique de la réaction d'une oxydortase de type ec 1.2.1.40 (Source: Akane700 [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] via Wikimedia Commons)
Schéma graphique de la réaction d'une oxydortase de type ec 1.2.1.40 (Source: Akane700 [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] via Wikimedia Commons) Exemple d'enzymes oxydortiques très courantes dans la nature est celle des déshydrogénases et des oxydases. Il pourrait être mentionné à l'enzyme de l'alcool déshydrogénase, qui catalyse la déshydrogénation de l'éthanol pour produire de l'acétaldéhyde dans un NAD + dépendant ou la réaction inverse, pour produire de l'éthanol pendant la fermentation alcoolique réalisée par certaines levures commercialement importantes commercialement importantes sur le commerce.
Les enzymes de la chaîne de convoyeurs électron dans les cellules aérobies sont des oxydortas en charge du pompage des protons, ils génèrent donc le gradient électrochimique à travers la membrane mitochondriale interne qui permet de renforcer la synthèse de l'ATP.
[TOC]
Caractéristiques générales
Les enzymes de l'oxydoréductase sont des enzymes qui catalysent l'oxydation d'un composé et la réduction concomitante d'un autre.
Ceux-ci nécessitent normalement la présence de différents types de coenzymes pour leur opération. Les coenzymes remplissent la fonction de donner ou d'accepter.
Ces coenzymes peuvent être le NAD + / NADH TORUS ou le couple FAD / FADH2. Dans de nombreux systèmes métaboliques aérobies, ces électrons et atomes d'hydrogène sont finalement transférés des coenzymes impliquées à l'oxygène.
Ce sont des enzymes avec un «manque» prononcé de spécificité du substrat, ce qui leur permet de catalyser les réactions croisées dans différents types de polymères, qu'il s'agisse de protéines ou de glucides.
Classification
Plusieurs fois, la nomenclature et la classification de ces enzymes sont basées à la fois sur le substrat principal qu'ils utilisent et le type de coenzyme dont ils ont besoin pour fonctionner.
Selon les recommandations du comité de nomenclature de l'Union internationale pour la biochimie et la biologie moléculaire (NC-IBMB), ces enzymes appartiennent à la classe E.C. 1 et inclure plus ou moins 23 types différents (e.C.1.1-e.C.1.23), qui sont:
Peut vous servir: érythropoïétine (EPO): caractéristiques, production, fonctions- ET.C. 1.1: qui agissent dans les groupes de donateurs CH-OH.
- ET.C. 1.2: qui agissent dans le groupe aldéhyde ou dans le groupe Oxo de Los Donor.
- ET.C. 1.3: qui agissent dans les groupes de donateurs CH-CH.
- ET.C. 1.4: qui agissent dans les groupes de donateurs CH-NH2.
- ET.C. 1.5: qui agissent dans les groupes CH-NH de donateurs.
- ET.C. 1.6: qui agit dans Nadh ou Nadph.
- ET.C. 1.7: qui agissent sur d'autres composés d'azote comme les donateurs.
- ET.C. 1.8: qui agissent sur les groupes de donateurs en soufre.
- ET.C. 1.9: qui agissent dans les groupes hémo de donateurs.
- ET.C. 1.10: qui agissent dans des donateurs tels que la diphénole et d'autres substances apparentées.
- ET.C. 1.11: qui agissent sur le peroxyde en tant qu'accepteur.
- ET.C. 1.12: qui agissent sur l'hydrogène en tant que donneur.
- ET.C. 1.13: qui agissent sur des donneurs simples avec l'incorporation d'oxygène moléculaire (oxygénases).
- ET.C. 1.14: qui agissent sur des donneurs "appariés", avec l'incorporation ou la réduction de l'oxygène moléculaire.
- ET.C. 1.15: qui agissent sur les superoxydes en tant qu'accepteurs.
- ET.C. 1.16: qui oxydent les ions métalliques.
- ET.C. 1.17: qui agit sur les groupes CH2.
- ET.C. 1.18: qui agissent sur des protéines qui contiennent du fer et supposent en tant que donneurs.
- ET.C. 1.19: qui agisse sur la réduction de la flavodoxine en tant que donneur.
- ET.C. 1.20: qui agissent sur des donateurs tels que le phosphore et l'arsenic.
- ET.C. 1.21: qui agit dans la réaction x-h + y-h = x-y.
- ET.C. 1.22: qui agissent sur l'halogène des donateurs.
- ET.C. 1.23: qui réduisent les groupes C-O-C en tant qu'accepteurs.
- ET.C. 1.97: Autres oxydoryductases.
Chacune de ces catégories comprend également des sous-groupes dans lesquels les enzymes sont séparées en fonction de la préférence des substrats.
Peut vous servir: succession primaire: caractéristiques et exemplesPar exemple, dans le groupe d'oxydoréductases qui agissent sur les groupes CH-OH de leurs donneurs, certains préfèrent NAD + ou NADP + comme accepteurs, tandis que d'autres utilisent des cytochromes, de l'oxygène, du soufre, etc.
Structure
Comme le groupe d'oxydoréductases est extrêmement diversifié, l'établissement d'une caractéristique structurelle définie est assez compliqué. Sa structure varie non seulement d'une enzyme à une enzyme, mais aussi de l'espèce ou du groupe d'êtres vivants et même de la cellule à la cellule dans différents tissus.
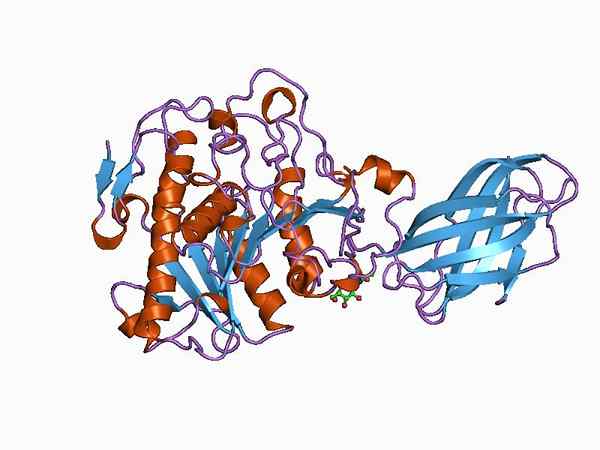
 Modèle de bioinformatique de la structure d'une enzyme d'oxyductase (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons)
Modèle de bioinformatique de la structure d'une enzyme d'oxyductase (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons) The enzyme pyruvate dehydrogenase, for example, is a complex composed of three sequentially linked catalytic subunits and known as the E1 subunit (dehydrogenase piruvate), the E2 subunit (dihydrolipamide acetyltransferase) and the E3 subunit (dihydrolipamide dehydrogenase).
Chacune de ces sous-unités, à son tour, peut être composée de plus d'un monomère protéique du même type ou de différents types, c'est-à-dire qu'ils peuvent être homodimériques (ceux avec seulement deux monomères égaux), hétérotrimérica (qui ont trois monomères différents) et ainsi de suite.
Cependant, ce sont généralement des enzymes composées de feuilles alpha et plaquées β disposées de différentes manières, avec des interactions intra-intermoléculaires spécifiques à différents types de types différents.
Les fonctions
Les enzymes oxydés catalysent les réactions de réduction de l'oxyde pratiquement dans toutes les cellules de tous les êtres vivants sur la biosphère. Ces réactions sont généralement réversibles, dans laquelle l'état d'oxydation d'un ou plusieurs atomes dans la même molécule est modifié.
Habituellement, les oxydorestones ont besoin de deux substrats, l'un qui agit comme un donneur d'hydrogène ou d'électrons (qui s'oxyde) et un autre qui agit comme un accepteur d'hydrogène ou d'électrons (qui est réduit).
Ces enzymes sont extrêmement importantes pour de nombreux processus biologiques dans différents types de cellules et d'organismes.
Ils fonctionnent, par exemple, dans la synthèse de la mélanine (un pigment qui se forme dans les cellules de la peau des humains), dans la formation et la dégradation de la lignine (composé structurel des cellules végétales), dans le pliage des protéines, etc.
Il peut vous servir: espèces introduites dans les îles GalapagosIls sont utilisés industriellement pour modifier la texture de certains aliments et l'exemple d'entre eux sont des peroxydases, de l'oxydase glucose et d'autres.
De plus, les enzymes les plus importantes de ce groupe sont celles qui participent en tant que transporteurs électroniques dans les chaînes de convoyeurs de la membrane mitochondriale, des chloroplastes et de la membrane plasmique interne des bactéries, où ce sont des protéines transmembranales.
Exemples d'oxydortas
Il existe des centaines d'exemples d'enzymes oxydortées dans la nature et l'industrie. Ces enzymes, comme mentionné, ont des fonctions de la plus haute importance pour le fonctionnement cellulaire et, par conséquent, pour la vie en soi.
Les oxydiductases incluent non seulement les enzymes de peroxydase, la lacquerie, l'oxydase glucose ou l'alcool déshydrogène; Ils combinent également des complexes importants tels que l'enzyme de glycéraldéhyde 3-phosphate déshydrogénase ou la complimenus déshydrogénase, etc., essentiel du point de vue du catabolisme du glucose.
Il comprend également toutes les enzymes du complexe de transport électronique dans la membrane mitochondriale interne ou dans la membrane interne des bactéries, similaire à certaines des enzymes trouvées dans les chloroplastes des organismes végétaux.
Peroxydases
Les peroxydases sont des enzymes très diverses et utilisent du peroxyde d'hydrogène comme accepteur d'électrons pour catalyser l'oxydation d'une variété de substrats, y compris les phénols, les amines ou les thioles, entre autres. Dans ses réactions, ils réduisent le peroxyde d'hydrogène jusqu'à ce qu'il produit de l'eau.
Ils sont très importants du point de vue industriel, étant la peroxydase du radis épicé le plus important et le plus étudié de tous.
Biologiquement parlant, les peroxydases sont importantes pour l'élimination des composés d'oxygène réactif qui peuvent causer des dommages significatifs aux cellules.
Les références
- Britannica Encyclopaedia. (2019). Récupéré le 26 décembre 2019 de www.Britannica.com
- Ercili-Cura, D., Hupperz, t., & Kelly, un. L. (2015). Modification enzymatique de la texture du produit laitier. Dans la modification de la texture alimentaire (pp. 71-97). Woodhead Publishing.
- Mathews, C. K., Van Holde, K. ET., & Ahern, k. g. (2000). Biochimie. AJOUTER. Wesley Longman, San Francisco.
- Nelson, D. L., Lehninger, un. L., & Cox, M. M. (2008). Principes de lehninger de la biochimie. Macmillan.
- Comité de nomenclature de l'Union internationale de biochimie et de biologie moléculaire (NC-IBMB). (2019). Récupéré de www.Qmul.CA.UK / SBCS / IUBMB / Enzyme / Index.Html
- Patel, m. S., Nemeria, n. S., Furey, w., & Jordan, F. (2014). Les complexes de pyruvate déshydrogénase: fonction et régulation de la base de la structure. Journal of Biological Chemistry, 289 (24), 16615-16623.

