Structure de nitrate d'argent (AGNO3), propriétés, utilisations, toxicité

- 4996
- 934
- Justine Charpentier
Il nitrate d'argent C'est un sel inorganique dont la formule chimique est Agno3. De tous les sels d'argent, c'est le plus économique et celui qui présente une stabilité relative contre la lumière du soleil, donc elle tend moins à décomposer. Il s'agit de la source d'argent soluble et pré -illect dans chaque laboratoire d'enseignement ou de recherche.
Dans l'enseignement, des solutions aqueuses en nitrate en argent sont utilisées pour enseigner les réactions de précipitation au chlorure d'argent. De même, ces solutions sont mises en contact avec du cuivre métal3)2.
 Conteneur d'échantillon de nitrate d'argent. Source: W. Oelen / CC By-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Conteneur d'échantillon de nitrate d'argent. Source: W. Oelen / CC By-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0) Dans l'image supérieure, une bouteille avec du nitrate d'argent est montrée. Il peut être maintenu exposé à la lumière sans s'assombrissant rapidement de ses cristaux, produit de l'apparition d'oxyde d'argent.
Suivant les coutumes alchimiques et les propriétés antibactériennes de l'argent métallique, le nitrate d'argent a été utilisé pour désinfecter et cautériser les plaies. Cependant, à cette fin, des solutions aqueuses très diluées sont utilisées, ou son solide mélangé avec du nitrate de potassium appliqué par la pointe des tiges en bois.
[TOC]
Structure de nitrate d'argent
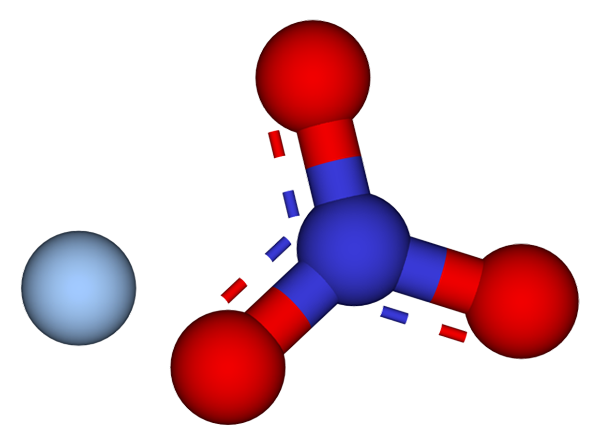 Ions qui composent les cristaux de nitrate d'argent. Source: CCOIL / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Ions qui composent les cristaux de nitrate d'argent. Source: CCOIL / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0) Dans l'image supérieure, les ions Ag sont affichés+ et non3- de nitrate d'argent, qui sont représentés par un modèle de sphères et de barres. La formule AGNO3 indique la proportion stoechiométrique de ce sel: pour chaque cation Ag+ Il y a un anion pas3- interagir avec lui électrostatiquement.
Il peut vous servir: Soufre: Historique, propriétés, structure, obtention, utilisationsL'anion non3- (des sphères rouges et bleuâtre) a une géométrie plate trigonale, la charge négative démocant entre ses trois atomes d'oxygène. Par conséquent, les interactions électrostatiques entre les deux ions ont lieu spécifiquement entre le cation AG+ et un atome d'oxygène de l'anion ne3- (Ag+-OU NON2-).
De cette façon, chaque AG+ finit par coordination ou entourant trois non3- adjacent dans le même plan ou la même couche cristallographique. Le regroupement de ces plans finit par définir un cristal dont la structure est ortorrombique.
préparation
Le nitrate d'argent est préparé en attaquant une pièce en argent métallique brunie avec de l'acide nitrique, qu'il soit froid ou concentré à chaud:
3 AG + 4 HNO3 (dilué) → 3 Agno3 + 2 h2O + Non
AG + 2 HNO3 (concentré) → Agno3 + H2O + Non2
Notez la formation de gaz no et non2, qui sont toxiques et obligent cette réaction à ne pas être effectuée à l'extérieur d'une cloche d'extracteur.
Proprietes physiques et chimiques
Apparence physique
Solide cristallin incolore, toilettes, mais goût très amer.
Masse molaire
169 872 g / mol
Point de fusion
209.7 ºC
Point d'ébullition
440 ºC. Cependant, à cette température, une décomposition thermique, dans laquelle se produit de l'argent métallique:
2 Agno3(L) → 2 AG (S) + O2 (g) + 2 Non2 (g)
Il n'y a pas de vapeurs Agno3, Du moins pas dans des conditions terrestres.
Solubilité
L'Agno3 C'est une économie d'eau incroyablement soluble, avec une solubilité de 256 g / 100 ml à 25 ° C. Il est également soluble dans d'autres solvants polaires tels que l'ammoniac, l'acide acétique, l'acétone, l'éther et le glycérol.
Densité
4,35 g / cm3 à 24 ºC (température ambiante)
Peut vous servir: eau distillée3,97 g / cm3 à 210 ºC (juste au point de fusion)
La stabilité
L'Agno3 C'est une substance stable chaque fois qu'elle est correctement stockée. Il ne deviendra pas enflammé à aucune température, bien qu'il puisse être décomposé en libérant des oxydes d'azote.
D'un autre côté, bien que le nitrate d'argent ne soit pas inflammable, c'est un puissant agent oxydant qui, lorsqu'il est en contact avec la matière organique et une source de chaleur, est capable de déclencher une réaction exothermique et explosive.
En plus de cela, ce sel ne doit pas être exposé trop de temps au soleil, car leurs cristaux sont assombris en raison de la formation d'oxyde d'argent.
Les utilisations du nitrate d'argent
Agent précipitant et analytique
Dans la section précédente, la mention de l'incroyable solubilité de l'Agno a été faite3 Dans l'eau. Cela implique que les ions agricoles+ Ils se dissoudront sans aucun problème et seront disponibles pour interagir avec n'importe quel ion moyen aqueux, comme les anions halogénides (x = f-, CL-, BR- et moi-).
Argent comme agir+, Et après l'ajout de HNO3 dilué, précipite les fluorures, les chlorures, les bromures et les iodures présents, qui se composent de solides blancs ou jaunâtres:
Agir+(ac) + x-(AC) → Agx (s)
Cette technique est très récurrente pour obtenir des halogénuros et est également utilisée dans de nombreuses méthodes analytiques quantitatives.
Réactif de tollens
L'Agno3 Il joue également un rôle analytique dans la chimie organique, car il s'agit du réactif principal, à côté de l'ammoniac, pour la préparation du réactif Tollens. Ce réactif est utilisé dans des essais qualitatifs qui permettent de déterminer la présence d'aldéhydes et de cétones dans un échantillon de problème.
La synthèse
L'Agno3 C'est une excellente source d'ions argentés solubles. En plus de son relatif et de son faible coût, en fait un réactif demandé pour d'innombrables synthèses organiques et inorganiques.
Il peut vous servir: Gibbs Free Energy: Unités, comment il est calculé, exercices résolusQuelle que soit la réaction, si vous avez besoin d'ions Ag+, Il est donc très probable que les produits chimiques recourent à Agno3.
Médicinal
L'Agno3 Il avait beaucoup de popularité en médecine avant l'apparition d'antibiotiques modernes. Aujourd'hui, cependant, il est toujours utilisé pour des cas spécifiques, car il possède des propriétés de palais et d'antibactériennes.
Habituellement, il est mélangé avec KNO3 À la pointe des tiges en bois, de sorte qu'elle est réservée exclusivement aux utilisations topiques. En ce sens, il a servi pour le traitement des verrues, des blessures, des ongles infectés, des ulcères de bouche nasale et des saignements. Le mélange Agno3-Kno3 Cauteriza La peau détruisant les tissus et les bactéries endommagées.
L'action bactéricide de l'Agno3 Il a également été utilisé dans la purification de l'eau.
Toxicité et effets secondaires
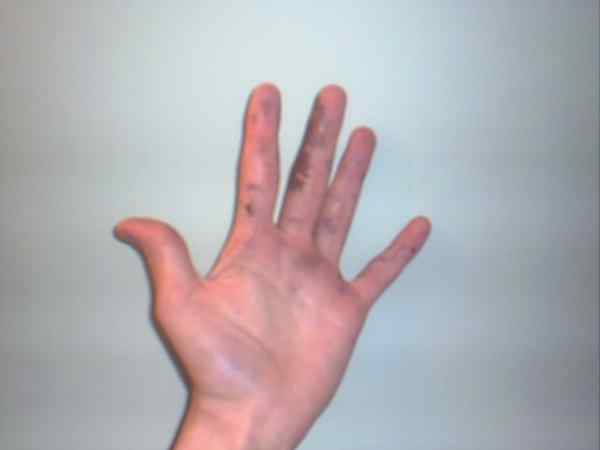 Le nitrate d'argent peut provoquer des brûlures affichées par leurs taches violettes ou sombres. Source: Jane de Baden chez English Wikipedia / Domain public
Le nitrate d'argent peut provoquer des brûlures affichées par leurs taches violettes ou sombres. Source: Jane de Baden chez English Wikipedia / Domain public Bien que le nitrate d'argent soit un salaire stable et ne représente pas trop de risques, c'est un solide très caustique, dont l'ingestion peut causer de graves dommages gastro-intestinaux.
C'est pourquoi sa manipulation avec des gants est recommandée. Il peut brûler la peau et, dans certains cas, l'assombrir jusqu'à ce qu'il devienne violet, état ou maladie connu sous le nom d'Argirie.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Nitrate d'argent. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2020). Nitrate d'argent. Base de données PubChem., CID = 24470. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Elsevier B.V. (2020). Nitrate d'argent. ScienceDirect. Récupéré de: ScienceDirect.com
- Université de l'Iowa. (2020). Utilisation et toxicité du nitrate d'argent. Récupéré de: médicament.Uiowa.Édu
- P.F. Lindley & P. Vers le bois. (1966). Un X-Recherche de rayons sur le nitrate d'argent: une structure de nitrate de métal unique. Journal of the Chemical Society A: inorganique, physique, théorique.
- Lucy Bell Young. (2020). Quelles sont les utilisations médicales du nitrate d'argent. Réactifs chimiques. Récupéré de: produits chimiques.co.ROYAUME-UNI
- « Structure de pipéridine, synthèse, dérivés, réactions
- Historique C ++, caractéristiques, types de données, exemples »

