Nitrate de calcium (CA (NO3) 2)

- 4743
- 770
- Louna Baron
Il nitrate de calcium C'est un sel inorganique tertiaire dont la formule chimique est CA (non3)2. De sa formule, il est connu que son solide est composé d'ions CA2+ et non3- Dans une proportion 1: 2. Par conséquent, c'est un composé de nature purement ionique.
L'une de ses propriétés est son caractère oxydant, suivant l'anion nitrate. Ce n'est pas du carburant, c'est-à-dire qu'il ne brûle pas à des températures élevées. Étant non alimenté, il représente un solide sûr pour le manipuler sans soins majeurs; Cependant, il peut accélérer l'allumage des matériaux combustibles.
 Nitrate de calcium solide. Source: Ondřej Manggl [domaine public], de Wikimedia Commons
Nitrate de calcium solide. Source: Ondřej Manggl [domaine public], de Wikimedia Commons Son apparence se compose d'un solide granulaire, qui présente une couleur blanc clair ou gris (image supérieure). Il peut être anhydre ou tétrahydrate, CA (non3)2· 4h2SOIT. Il est très soluble dans l'eau, le méthanol et l'acétone.
Le nitrate de calcium a été largement utilisé comme engrais, car il se déplace facilement dans un sol humide et est rapidement absorbé par les racines des plantes. Fournit deux éléments importants pour la nutrition et la croissance des plantes: l'azote et le calcium.
L'azote est l'un des trois éléments essentiels pour le développement des plantes (N, P et K), il est essentiel dans la synthèse des protéines. Pendant ce temps, le calcium est nécessaire pour maintenir la structure de la paroi cellulaire des plantes. Pour cette raison le CA (non3)2 Les jardins sont très destinés.
D'un autre côté, ce sel a des actions toxiques, en particulier par contact direct avec la peau et les yeux, ainsi qu'en inhalant sa poussière. De plus, il peut être décomposé en réchauffant.
Structure de nitrate de calcium
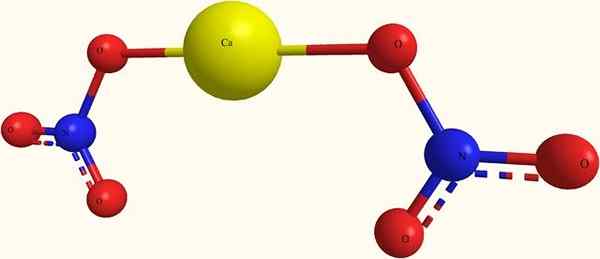 Ions de nitrate de calcium. Source: я.Hardnox à ru.Wikipedia [domaine public], de Wikimedia Commons
Ions de nitrate de calcium. Source: я.Hardnox à ru.Wikipedia [domaine public], de Wikimedia Commons Dans l'image supérieure, la structure du CA (non3)2 Dans un modèle de sphères et de barres. Ici, cependant, il y a un défaut: l'existence de liaisons covalentes Ca-O est supposée, ce qui contredit son caractère ionique. Clarifiant cela, les interactions sont vraiment du type électrostatique.
Le Cation Ca2+ Il est entouré de deux anions non3- Selon ses proportions dans le verre. L'azote sous forme de nitrate dans la structure cristalline prédomine.
Les ions sont regroupés de telle manière qu'ils établissent une configuration dont l'expression minimale est la cellule unitaire; qui, pour le sel anhydre, est cubique. C'est-à-dire, à partir de cubes contenant la proportion 1: 2 pour ces ions, le verre entier est reproduit.
Peut vous servir: étain: structure, propriétés, obtention, utilisationsD'un autre côté, le sel de tétrahydrate, CA (non3)2· 4h2Ou, il a quatre molécules d'eau pour chaque ensemble3- CA2+ NON3-. Cela modifie la structure cristalline, la déformant dans une cellule monoclinique unitaire.
Par conséquent, les cristaux pour les deux sels, anhydrates et tétrahydrates, sont différents; Différences qui peuvent être déterminées dans leurs propriétés physiques, par exemple, des points de fusion.
Proprietes physiques et chimiques
Noms chimiques
-Nitrate de calcium
-Dinitrate de calcium
-Nitrocalcita
-Salitre norvégien et limesaltpetro.
Formule moléculaire
Bec3)2 ou peut2SOIT6
Poids moléculaire
Anhidro 164 088 g / mol et tétrahydrate 236,15 g / mol. Remarquez l'effet de l'eau sur le poids moléculaire et ne peut pas être méprisé lors de sa réalisation.
Aspect physique
Granules solides ou gris clair. Cristaux blancs cubes ou délicieux granules; c'est-à-dire qu'ils absorbent l'humidité au point qu'ils dissolvent le produit de leur forte solubilité.
Point d'ébullition
La forme anhydre se décompose par chauffage à une température qui empêche la détermination de son point d'ébullition; Tandis que la forme de sel tétrahydrate a un point d'ébullition de 132 ºC (270 ºF, 405 K).
Point de fusion
-Formulaire anhydra: 561 ºC à 760 mmHg (1042 ºF, 834 K).
-Forme de tétrahydrate: 42,7 ºC (109 ºF, 316 K).
Cela montre comment les molécules d'eau interfèrent avec les interactions électrostatiques entre le CA2+ et non3- à l'intérieur des cristaux; Et par conséquent, le solide fond à une température beaucoup plus bas.
Solubilité dans l'eau
-Formulaire anhydra: 1212 g / L à 20 ºC.
-Forme de tétrahydrate: 1290 g / L à 20 ºC.
L'eau dans les cristaux augmente à peine la solubilité du sel.
Solubilité dans les solvants organiques
-En éthanol, 51,42 g / 100 g à 20 ºC.
-En méthanol, 134 g / 100 g à 10 ºC.
-Dans l'acétone, 168 g / 100 g à 20 ºC.
Acidité (PKA)
6.0
Densité
2,5 g / cm3 à 25 ºC (tétrahydrate).
Décomposition
Lorsque le nitrate de calcium est chauffé à incandescence, il se décompose en oxyde de calcium, oxyde d'azote et oxygène.
Profil réactif
C'est un agent fortement oxydant, mais ce n'est pas du carburant. Accélère l'allumage des matériaux combustibles. La division de nitrate de calcium en particules fines, facilite son explosion lorsque le composé est exposé à un feu prolongé.
Peut vous servir: alliages non ferreux: structure, propriétés, utilisations, exemplesLes mélanges avec des esters alkyles deviennent explosifs en provoquant des esters de nitrate d'alkyle. La combinaison de nitrate de calcium avec du phosphore, du chlorure d'étain (II) ou d'un autre agent réducteur, peut réagir de manière explosive.
Applications
Agriculture
Il est utilisé dans les cultures comme source d'azote et de calcium. Le nitrate de calcium est très soluble dans l'eau et facilement absorbé par les racines des plantes. De plus, il n'acifie pas les sols car leurs ions ne peuvent pas hydrolyiser de manière significative.
Son mélange doit être évité avec des engrais contenant du phosphore ou du sulfate, pour éviter la formation de sels insolubles. Après votre hygroscopicité, il doit être stocké dans un environnement sec et frais.
Son utilisation a un avantage sur l'utilisation du nitrate d'ammonium comme engrais. Tandis que ce dernier composé apporte de l'azote aux plantes, interfère avec l'absorption du calcium, qui pourrait produire une carence en calcium dans les plantes.
Le calcium contribue au maintien de la structure de la paroi cellulaire de la plante. En présence d'une carence en calcium, les tissus de la formation des plantes, tels que les pointes des racines, les jeunes feuilles et les pointes des épidémies, montrent souvent une croissance déformée.
Diminution de l'ammonium
Le nitrate de calcium réduit l'accumulation d'acides gras volatils et de composés phytotoxiques phénoliques qui s'accumulent par la décomposition des déchets de cultures de soja.
De plus, il existe une tendance au nitrate de calcium pour réduire la concentration d'ammonium dans le sol, ce qui augmente la capacité d'amortissement de l'hydrogène.
Béton
Le nitrate de calcium est utilisé pour réduire le temps de réglage du béton. Ceci est produit par la génération d'hydroxyde de calcium, par peut-être une double réaction de déplacement.
De plus, le nitrate de calcium induit la génération de composé d'hydroxyde de fer, dont l'action protectrice du béton réduit sa corrosion. C'est-à-dire que le fer présent peut réagir avec les composants de base du béton, comme l'hydroxyde de calcium lui-même.
Le nitrate de calcium diminue le temps de réglage, ainsi que la résistance du béton, auquel les cendres volcaniques ont été ajoutées. Pour étudier l'effet de l'agrégat de nitrate de calcium en béton, des concentrations croissantes de nitrate de calcium, entre 2% et 10%, ont été utilisées.
Il peut vous servir: fraction molaire: comment il est calculé, exemples, exercicesUne plus grande diminution du temps de réglage a été observée, ainsi qu'une augmentation de la résistance au béton à mesure que la concentration en nitrate de calcium a augmenté à 10%.
Eaux usées ou traitement des déchets
Le nitrate de calcium est utilisé pour réduire les mauvaises odeurs des eaux usées, en diminuant le sulfure d'hydrogène. De plus, la matière organique générant des conditions anaérobies qui entrave la survie de nombreuses espèces biologiques est consommée.
Prépression de la compresse à froid
Le nitrate de calcium tétrahydraté est un composé endothermique, c'est-à-dire qu'il a la capacité d'absorber la chaleur de l'environnement qui l'entoure. Cela produit un refroidissement des corps qui entrent en contact avec les conteneurs qui le contiennent.
Les compresses augmentent leur température et pour les régénérer, il suffit de les placer dans un congélateur
Coagulation en latex
Le nitrate de calcium est utilisé dans la phase de coagulation en latex. Il fait partie de la solution d'immersion, et lorsqu'elle entre en contact avec la solution que contient le latex, il casse sa stabilisation et provoque sa coagulation.
Transfert de chaleur et stockage
Le mélange binaire de nitrates en fusion, y compris le calcium avec d'autres nitrates, est utilisé à la place de l'huile thermique dans les usines d'énergie solaire pour le transfert de chaleur et le stockage.
Formes d'application
-Le nitrate de calcium mélangé à la terre est appliqué à une concentration de 1,59 kg pour 30,48 m2, avec une irrigation adéquate. Le nitrate de calcium est solubilisé dans l'eau, permettant son absorption par les racines de la plante. Dans les cultures hydroponiques, il se dissout dans l'eau de culture.
-Le nitrate de calcium en forme de pulvérisation est également utilisé pour pulvériser les feuilles et les fleurs, étant un traitement efficace dans la prévention de la pourriture de la fleur de tomate, de la tache de liège et du trou amer de la pomme.
-Il est ajouté au mélange de formation en béton (ciment, sable, pierres et eau) une quantité de nitrate de calcium, et l'effet de l'ajout de celui-ci a sur les propriétés spécifiques du béton; comme la vitesse de réglage et la résistance.
-Le nitrate de calcium est ajouté à une concentration adéquate pour réduire les mauvaises odeurs d'eaux usées ou résiduelles, à un niveau que les odeurs sont tolérables pour les personnes.
Les références
- Spécifications de nitrate de calcium. Récupéré de: Direct2Farmer.com
- Nitrate de calcium. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- « Que sont les types, les caractéristiques, les caractéristiques
- Histoire et signification du drapeau indonésien »

