Modifications post-radicaux
- 2148
- 353
- Mlle Ambre Dumont
Quelles sont les modifications post-traductionnelles?
Les modifications post-traductionnelles sont des modifications réversibles ou irréversibles ou des altérations chimiques.
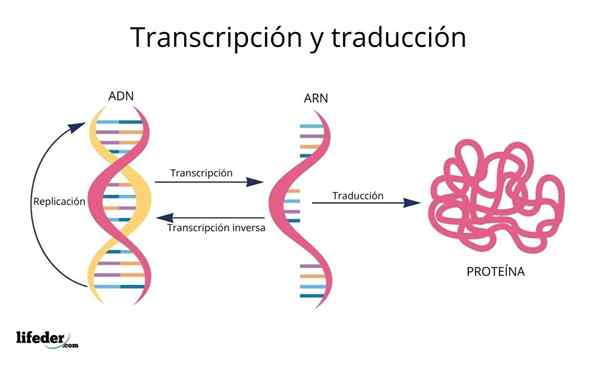
La traduction est le résultat de la «lecture et interprétation» des informations contenues dans les gènes trouvés dans le noyau eucaryote (se produit également chez les procaryotes).
L'ensemble de gènes d'une cellule -génome- C'est là que les instructions doivent produire toutes les protéines structurelles et les enzymes que l'on trouve à l'intérieur cellulaire, dont dépendent les processus et les fonctions vitales de chaque cellule.
Les gènes sont formés par l'ADN (acide désoxyribonucléique), qui est une macromolécule formée par deux chaînes complémentaires d'un polymère composé de 4 types de molécules différentes appelées bases d'azote, À savoir: Adenina, Timina, Guanina et Cytosine.
L'ADN est donc une sorte de alphabet Avec des informations lues et traduites.
Avant la traduction, les informations dans l'ADN sont d'abord transcrit Dans le noyau à une autre molécule très similaire, l'ARN (acide ribonucléique), sous la forme de molécules appelées ARN messager, qui sont ensuite transportés vers le cytosol.
L'ARN est très similaire à l'ADN, mais est formé par une seule chaîne composée de bases d'azote d'adénine, d'uracile, de guanine et de cytosine.
Les ARN messager, dérivés des séquences de protéines codants génétiques, sont par la suite "lues" et leur séquence est traduit dans les séquences peptidiques des protéines cellulaires à l'aide de ribosomes et d'autres molécules d'ARN appelées Transférer l'ARN que, comme son nom l'indique, Ils transfèrent les acides aminés appropriés à la protéine qui est synthétisée.
L'ordre dans lequel ces acides aminés sont ajoutés dans les protéines naissants est dicté par la séquence des gènes qui les codent, c'est-à-dire par ordre des bases d'azote dans la séquence d'ADN.
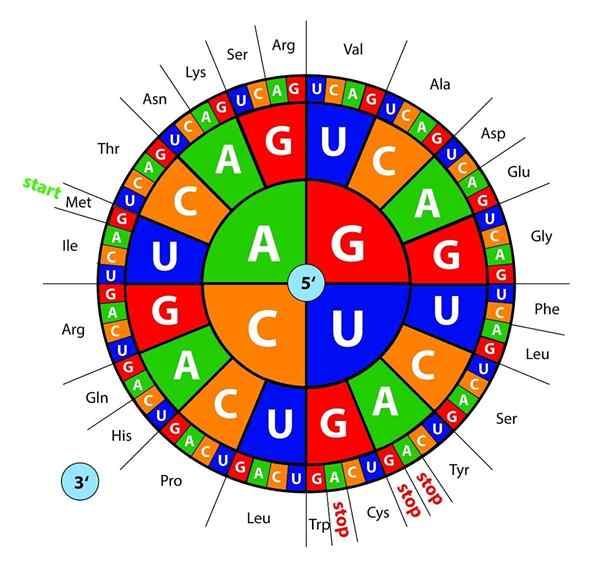
Les bases d'ADN, transcrites en ARN, sont "lues" par des ribosomes dans des trios ou des triplets appelés codons, chacun de ces encoder pour l'un des 20 acides aminés avec lesquels les protéines se forment; Voici ceci code génétique est interprété comme présentant, dans le bon ordre, un acide aminé en même temps.
Modifications post-traductionnelles
La plupart des caractéristiques physicochimiques et fonctionnelles de chaque protéine dépendent principalement des informations codées dans l'ADN.
Cependant, les cellules parviennent à augmenter considérablement la diversité de leurs protéines par des modifications post-traductionnelles, qui ne sont rien de plus que des modifications chimiques - médiées par des enzymes - qui souffrent de certaines protéines après leur traduction.
Il peut vous servir: glucose oxydase: caractéristiques, structure, fonctionsPar conséquent, les caractéristiques de certaines protéines ne peuvent pas être déduites uniquement de la séquence d'acides aminés qui dérive des informations génétiques.
Ces modifications se produisent généralement sur les déchets d'acides aminés qui font.
Plus de 500 modifications post-traductionnelles ont été décrites, mais parmi celles les plus connues et étudiées sont la phosphorylation, la formation de ponts disulfure, de méthylation, d'acétylation, d'hydroxylation, de glycosylation, de prénilation, d'ubiquitination et de carboxylation.
Processus de modification post-radical
Les modifications post-traductionnelles, comme nous l'avons commenté, sont des modifications chimiques qui souffrent de protéines cellulaires eucaryotes après que leur synthèse s'est produite, c'est-à-dire leur traduction.
Ils ont généralement à voir avec l'ajout de groupes chimiques et / ou la modification des déchets d'acides aminés qui composent des protéines, mais certaines modifications importantes ont également à voir avec l'établissement de liaisons entre les acides aminés de la même protéine, ou également avec l'élimination des acides aminés o peptides signes par coupes ou Clivajes protéolytique.
Ces modifications sont possibles grâce à la présence de certaines enzymes cellulaires spécialisées et, en outre, des substrats énergétiques de petite taille - ce ne sont pas des réactions spontanées - comme, par exemple:
- L'ATP (adénosine 5-phosphate)
- Acétyl coenzyme A (acétyl co-a)
- Le NAD + (5'-nicinamide 5'-diphosphate adénosine)
- S-Adenosil Metionina (SAM)
- L'uracile de 5'-diphosphate N-Acétyl glucosamine (UDP-GRCNAC)
- Uracile 5'-glucose diphosphate (UDP-glucose)
- Entre autres
Certaines des modifications de traduction des post-traductions les plus importantes agissent comme interrupteurs (Suivi) Moléculaire qui activent ou désactivez les fonctions enzymatiques de certaines protéines, régularisant leur fonction cellulaire ou même son emplacement intracellulaire.
Par exemple, de nombreuses protéines appartenant à des organites intracellulaires sont synthétisées dans le cytosol avec des extrémités N-o-terminales qui correspondent à Séquences de signalisation, qui sont reconnus par d'autres protéines chargées de les diriger vers le compartiment approprié et, en cours, ces signaux sont généralement retirés de la structure des protéines.
Un autre exemple très frappant de modifications post-traductionnelles qui ont à voir avec la clivaje protéolytique est celle de certaines hormones et enzymes avec activité de protéase, qui sont synthétisées comme des protéines inactives qui ont besoin de l'élimination protéolytique de certains de leurs acides aminés pour devenir leurs formes actives.
Protéines conjuguées
Bien qu'ils ne soient pas toujours reconnus comme tels, d'autres modifications post-traductionnelles très importantes sont celles qui impliquent la formation de protéines dont la structure est composée d'une ou plusieurs chaînes peptidiques associées à un composé non protéique, soit par des liaisons covalentes ou des interactions plus faibles et transitoire.
Généralement, ces protéines sont classées en fonction de l'identité de la fraction non-protéine et nécessitent de telles parties pour remplir leurs fonctions.
Il peut vous servir: gélose sanguineCes fractions ou parties sont connues sous le nom Groupes prothétiques Et un bon exemple de ces protéines est l'hémoglobine, qui est associée à un groupe Hemo.
Réticulum endoplasmique en action
De nombreuses modifications post-traductionnelles commencent à l'intérieur du réticulum endoplasmique rugueux, où les ribosomes associés traduisent les protéines car elles sont insérées dans la membrane de cet organelle.
Dans le réticulum endoplasmique, de nombreuses protéines acquièrent leur conformation structurelle finale: leurs séquences de signalisation sont supprimées, replient la forme appropriée, des ponts de disulfure se forment, des groupes sucrés sont ajoutés, etc.
Types de modifications post-traductionnelles
Plus de 500 types de modifications post-traductionnelles différentes ont été décrites dans les cellules eucaryotes; La liste suivante regroupe certains des plus étudiés:
-
Phosphorylation
Transfert d'un ou plusieurs groupes de phosphate de molécules à haute énergie, telles que l'ATP, vers le groupe hydroxyle des acides aminés tels que la sérine, la treonine et la tyrosine; Il est médié par les enzymes du groupe Protéines des hommes (Ces phosphates sont éliminés par des enzymes phosphatases).
Il est important dans de nombreux événements cellulaires tels que la division, la transduction du signal, le métabolisme des glucides, la croissance cellulaire et la progression du cycle cellulaire, entre autres.
-
Sulfonation
Ceci est l'ajout d'un groupe -SO3H (sulfonique) exclusivement dans le gaspillage de l'acide aminé de tyrosine et est typique des protéines ou protéines transmembraales qui sont excrétées. Il est catalysé par les enzymes tyrosil-sulfotransférase.
Il s'agit d'un processus important pour le fonctionnement de nombreux récepteurs membranaux, pour certains types de signalisation intracellulaire, etc.
-
Formation du pont de disulfure entre les cystéines
Ce processus se produit entre les résidus de cystéine et est l'une des modifications post-traductionnelles les plus importantes du point de vue structurel. Les ponts disulfure sont établis dans des organites tels que le complexe de Golgi et le réticulum endoplasmique, qui ont des environnements oxydants.
Cette modification post-traductionnelle a à voir avec l'établissement d'une certaine configuration structurelle qui est généralement très importante pour l'activité de nombreuses enzymes.
-
Méthylation
Il se compose de l'ajout de groupes méthyle dans les acides aminés tels que la lysine, l'arginine, l'histidine, la glutamine et l'asparagine (N-méthylation), comme l'aspartate et le glutamate (O-méthylation) ou comme cystéine (S-méthylation).
Il se produit grâce à l'action catalytique des enzymes appelées n-, O ou S-méthyltransférases. La méthylation des protéines est essentielle pour la régulation de la transcription génétique au niveau de la protéine histone, mais a également un rôle plus faible dans la transduction du signal.
-
Acétylation
Cela implique l'ajout de groupes d'acétyle aux résidus de lysine de certaines protéines. Il est catalysé par les enzymes de l'acétyltransférase et a également des fonctions très importantes du point de vue de la régulation de l'expression génétique (au niveau des protéines histones, qui se lient à l'ADN).
-
Hydroxylation
Il se produit généralement dans les déchets de proline, de lysine et d'asparagine et est catalysé par des enzymes hydroxylases dépendantes du fer. Les acides aminés résultants, l'hydroxyprol et l'hydroxilisine sont très importants pour la maturation de certaines protéines (y compris le collagène) et pour certains composés antibiotiques et antifongiques (hydroxiasparagine).
-
Glycosylation
Cette modification est un processus très important pour les cellules eucaryotes. Il se produit principalement sur les déchets de sérine et d'asparagine, mais il peut également se produire sur des hydroxyprolines ou des hydroxilisines.
Il peut vous servir: évolutionnisme: origine, darwin, social, linéaire et culturelIl se compose de l'ajout de molécules de glucides à la structure des protéines et est catalysée par des enzymes glycosyltransférase et se produit en particulier dans les protéines d'excrétion et dans celles trouvées à la surface cellulaire.
-
Prenila
Il se compose du transfert de groupes Isaprenilos (Lipid) à certaines protéines. Les enzymes en charge sont des transfrases spécifiques pour chaque groupe.
Ce processus est important pour l'ancrage de certaines protéines aux membranes cellulaires, mais se produit également pendant la transduction du signal, etc.
-
Ubiquitination
Il s'agit de l'ajout covalent d'une ou plusieurs copies du peptide connu sous le nom Ubiquitine. Cet ajout marque Aux protéines pour la dégradation dans un complexe protéique connu sous le nom de protéosome 26S.
Il représente un système de régulation intracellulaire très efficace et est responsable de la destruction des protéines par une voie dépendante de l'ATP et avec la participation de trois enzymes différentes appelle E1, E2 et E3.
Exemples
La phosphorylation et la glysilation sont deux modifications post-traductionnelles extrêmement importantes pour la vie cellulaire. Non seulement parce qu'ils contrôlent de nombreux processus liés à la communication et au cycle cellulaire, mais aussi parce qu'ils sont très courants chez les eucaryotes.
La protéine p53, par exemple, est une protéine connue sous le nom de "suppresseur de tumeur" qui est utilisée pendant certains traitements contre le cancer. Son activation dépend de l'action de différentes protéines kinases qui sont responsables de la phosphorylation de son extrémité N-terminale.
D'un autre côté, la surface cellulaire eucaryote contient un grand nombre de glycoprotéines (protéines modifiées post-traductionnelles par l'ajout de glucides).
Beaucoup de ces protéines ont des fonctions importantes en reconnaissance immunitaire, dans la migration cellulaire, en reconnaissance et en union avec les récepteurs, entre autres.
Les références
- Alberts, B., Bray, D., Hopkin, k., Johnson, un. D., Lewis, J., Raff, m.,… & Walter, P. (2015). Biologie cellulaire essentielle. Garland Science.
- Cox, M. M., & Nelson, D. L. (2008). Principes de lehninger de la biochimie. Wh Freeman.
- Garrett, R. H., & Grisham, C. M. (1999). Biochimie.
- Vert, k. D., & Garneau-Tesodikova, S. (2010). Modification post-traductionnelle des protéines.
- Walsh, C. T., Garneau --Sodikova, S., & Gatto Jr, G. J. (2005). Modifications post-traductionnelles des protéines: la chimie des diversifications du protéome. Angewandte Chemie International Edition, 44 (45), 7342-7372.