Modèle corpusculaire de matière
- 4777
- 944
- Mlle Ambre Dumont
 Les états les plus connus de la question ont leur explication dans le modèle corpusculaire de la question
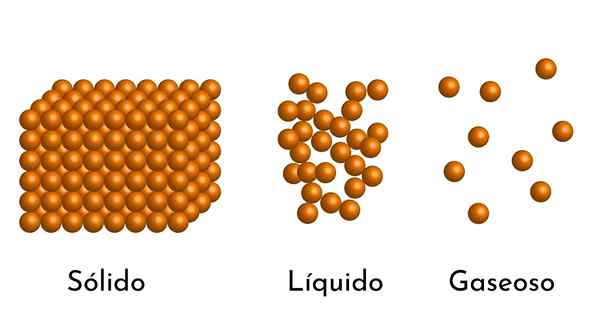
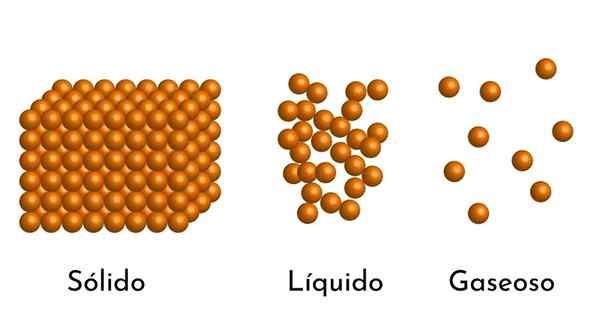
Les états les plus connus de la question ont leur explication dans le modèle corpusculaire de la question Quel est le modèle corpusculaire de la matière?
Il Modèle corpusculaire de matière Il s'agit d'un modèle de la structure microscopique de la matière, qui cherche à expliquer les propriétés et le comportement dans chaque état d'agrégation.
Le postulat fondamental du modèle est que la matière est composée de petites particules, qui peuvent être des atomes, des ions ou des molécules, toujours en agitation continue.
Dans ce modèle, les lois de la mécanique classique aux particules s'appliquent, bien que par le grand nombre présent, ils ne sont pas étudiés individuellement mais par un traitement statistique. De cette façon, les valeurs moyennes des amplitudes macroscopiques d'intérêt, telles que la pression, la température et le volume, sont obtenues.
Le modèle corpusculaire explique également des propriétés telles que la viscosité, la dureté, la flexibilité et la densité des matériaux, ainsi que la dilatation thermique, entre autres phénomènes.
Origines du modèle corpusculaire de la matière
Les idées sur la nature corpusculaire de la matière datent au moins le 5ème siècle.C. Dans la Grèce antique, Leucipo (450 A. C. - 370 A. C.) et le démocrite (460 à 370 à c), disciple de cela, avait spéculé sur l'organisation de la matière au niveau microscopique.
Ces philosophes ont proposé que la matière est composée de minuscules particules indivisibles, nommées atomes, Un mot de racine grecque qui signifie précisément "indivisible".
La théorie a été exclue par Aristote, le sage le plus influent de son temps. Cependant, ce n'est qu'au XVIIe siècle que la théorie corpusculaire a recommencé à reprendre la pertinence, et au 19e siècle, les secrets de la matière ont finalement commencé à révéler.
En 1803, le chimiste anglais John Dalton (1766-1844) a de nouveau proposé que l'affaire soit formée par des corpuscules appelés atomes, qui combinaient dans certaines proportions pour former les molécules d'une substance.
Les atomes de Dalton étaient indivisibles, mais bientôt une solide structure théorique a été développée, en particulier grâce à James C. Maxwell (1831-1979) et Ludwig Boltzmann (1844-1906). Cela a établi les fondements de la mécanique statistique et la physique du solide à l'état solide.
Il peut vous servir: vitesse moyenne: formules, comment elle est calculée et résolueFondamentaux du modèle corpusculaire de la matière
Les principaux postulats du modèle sont:
- La matière, quel que soit leur statut d'agrégation, est formée par des particules microscopiques, qui peuvent être des atomes individuels ou combinés, pour former des molécules.
- Les différentes substances diffèrent les unes des autres car elles sont constituées par différentes particules.
- Selon l'état de l'agrégation de la matière, il y a des espaces vides entre les particules, plus grands dans les gaz et plus petits en solides.
- Les particules qui constituent la question sont en agitation perpétuelle. Pour une plus grande agitation, une plus grande énergie cinétique qu'ils ont, et si la chaleur est ajoutée, le mouvement des particules augmente.
- De plus, dans les liquides et les solides, les particules connaissent une attirance d'intensité différente, en raison des forces intermoléculaires. Dans les gaz, les molécules sont très séparées et se déplacent rapidement, donc ces forces n'ont pas d'incidence plus importante. Mais dans les liquides, dont les particules ont plus de cohésion, ces forces sont plus intenses et en solides, il est encore plus grand.
Théorie cinétique des gaz
Le modèle corpusculaire a été appliqué d'abord aux gaz, car c'est l'état le plus simple d'agrégation et les forces de cohésion entre les molécules. De plus, les propriétés des gaz étaient bien connues à travers les œuvres expérimentales du chimiste anglais Robert Boyle et du Français Joseph Gay Lussac et Jacques Charles.
Le modèle de gaz idéal, le plus simple, envisage que:
- La taille des particules est beaucoup plus petite que les distances entre elles et que les dimensions du conteneur. Ce sont des masses spécifiques, c'est-à-dire manquant de dimensions et n'occupe pas un volume.
- Les particules sont en agitation permanente, étant leur mouvement uniquement de traduction.
- Parfois, les particules s'affrontent élastiquement, les unes avec les autres et avec les murs du récipient. Dans les chocs totalement élastiques, l'énergie cinétique est préservée.
- Il n'y a pas de forces attractives entre les molécules. Les seules interactions sont dues à des collisions qui se produisent de temps en temps et pendant très peu de temps. Du reste, chaque molécule agit indépendamment des autres.
- S'il n'y a pas de forces externes agissant sur le système de particules, ceux-ci sont distribués uniformément tout au long du volume disponible.
Bien qu'il s'agisse du modèle le plus simple, explique le comportement de tout gaz dense à des températures élevées et des pressions basse. Les scientifiques ont développé d'autres modèles mieux ajustés au comportement des gaz réels, car ils considèrent que:
- Les molécules ont une taille mesurable.
- Les forces intermoléculaires ne sont pas annulées.
Équation de gaz idéale
Grâce aux postulats du gaz idéal, une expression se produit qui relie les amplitudes macroscopiques de la pression P, du volume V et de la température T:
P ∙ v = nrt
Où n est le nombre de moles de gaz et R est la constante universelle des gaz, dont la valeur dans les unités du système international est de 8.314 J / mol ∙ K.
Énergie et température cinétiques
Dans un gaz idéal, toute l'énergie interne se manifeste comme une énergie cinétique. L'énergie cinétique moyenne des molécules N d'un gaz idéal est directement proportionnelle à sa température à Kelvin:
Modèle corpusculaire dans les liquides et les solides
En fait, toute la matière peut être trouvée dans les trois états les plus simples: comme le gaz, le liquide ou le solide, selon la pression et la température. Il existe d'autres états d'agrégation tels que le plasma, mais pas près de la surface de la terre.
Ces états sont dus à la façon dont les forces d'attraction intermoléculaires agissent, qui sont courtes, c'est-à-dire qu'elles n'agissent pas si la distance entre les molécules est très grande et que les particules se déplacent à grande vitesse. C'est le cas des gaz, qui permet le phénomène du la diffusion plus rapide. Cela explique qu'en découvrant l'arôme, l'arôme se propage rapidement.
Peut vous servir: quel est le moment magnétique?D'un autre côté, lorsque les particules sont plus proches et que leur mouvement est plus lent, comme dans les liquides et les solides, ces forces intermoléculaires ont la possibilité d'exercer leur action.
Ainsi, lorsqu'un gaz passe à l'état liquide, son volume diminue, car la distance entre ses particules diminue, et encore plus quand elle devient solide.
Compte à l'état liquide
Dans l'état liquide, les forces intermoléculaires ne sont pas méprisables, mais agissent à plus petite échelle qu'à l'état solide. Les particules forment de petits groupes, qui se désintégrent et se regroupent en continu, fournissant une mobilité au matériau, bien que le maintien d'un volume fixe.
Cette mobilité permet aux liquides de s'adapter à la forme du récipient et leur donne la possibilité de couler, en plus de pouvoir mélanger plus facilement. La diffusion peut se produire, mais plus lentement que dans les gaz.
Même ainsi, les particules ont suffisamment de cohésion pour que le liquide reste incompressible dans une large plage de températures.
Tension superficielle
À la surface du liquide, il y a des molécules sur lesquelles les forces intermoléculaires déséquilibrées agissent, donnant naissance à une force nette. Cette force nette est minimisée lorsque le liquide a la surface la plus basse possible.
Grâce à cette force, des épingles, des clips, des insectes et d'autres petits objets parviennent à rester sur la surface immobile de l'eau sans couler.
 Dans cette image, une molécule peut être vue à la surface du liquide, sur lequel une force nette agit, ce qui permet à l'insecte de marcher sur l'eau sans couler
Dans cette image, une molécule peut être vue à la surface du liquide, sur lequel une force nette agit, ce qui permet à l'insecte de marcher sur l'eau sans couler Solide à l'état solide
À l'état solide, les particules sont très proches les unes des autres, et les forces intermoléculaires font que les particules restent en position fixe. Bien qu'ils puissent vibrer autour de cette position, les solides adoptent une forme définie et maintiennent leur volume constant.
Lorsque la chaleur circule, l'amplitude du mouvement vibratoire augmente et la température augmente. Cela entraîne une augmentation des dimensions du corps avec la température, un phénomène appelé Dilatation thermique. Si suffisamment de chaleur, le solide peut même aller à la phase liquide.


