Modèle atomique de Dalton

- 3018
- 540
- Adrien Remy
Nous expliquons le modèle atomique de Dalton, ses postulats et ses limites
 Le modèle atomique de Dalton a été le premier à être basé sur la recherche scientifique. Source: F. Zapata.
Le modèle atomique de Dalton a été le premier à être basé sur la recherche scientifique. Source: F. Zapata. Quel est le modèle atomique de Dalton?
Il Modèle atomique de Dalton Il propose que toute la matière soit composée d'unités minuscules et indivisibles, appelées atomes, reprenant les idées que les anciens penseurs grecs avaient formulés il y a deux mille ans.
C'est le premier modèle atomique qui est sorti d'une expérimentation minutieuse en laboratoire, car bien que l'humanité ait toujours essayé de comprendre ce qui est la matière, jusqu'au début du XIXe siècle, les possibilités de vérifier expérimentalement les théories étaient encore limitées.
Cependant, en plus d'être un bon observateur de la nature, le professeur d'anglais John Dalton (1766-1844), s'est également démarqué dans le domaine de l'instrumentation, car il a créé plusieurs dispositifs de mesure, qu'il utiliserait plus tard dans son laboratoire pour l'étude de la des gaz.
Ainsi, Dalton s'est rendu compte que les substances sont combinées à la suite de certaines règles, et pour l'expliquer, il a postulé que toute la matière était composée d'atomes, de sphères minuscules et homogènes et de structure interne manquante. Les atomes, a-t-il dit, forment des composés après certaines proportions, et lors d'une réaction chimique, ils se séparent et se combinent à nouveau, créant de nouveaux composés.
Dalton a non seulement développé le premier modèle atomique basé sur une expérimentation rigoureuse. Il a également créé un système de nomenclature pour les éléments, leur a ordonné leur poids atomique, établi la loi de plusieurs proportions, la loi des pressions partielles et décrit la cécité à certaines couleurs, une condition que lui-même, appelée, appelée, appelée lui-même, appelée lui-même daltonisme.
Ses grandes contributions à la science ont gagné de nombreuses distinctions tout au long de sa carrière scientifique, mais Dalton a toujours vécu de manière modeste et simple, dédiée à la science jusqu'à la fin de ses jours.
Brève histoire
Depuis les temps éloignés, l'humanité a demandé une explication sur la nature de la matière. Penseurs grecs du 5ème siècle.C, et avant eux, certains philosophes hindous, ont postulé que l'affaire était constituée par des unités élémentaires appelées atomes. Cependant, ils n'avaient pas le soutien expérimental nécessaire pour vérifier leurs théories.
Peut vous servir: quelles sont les propriétés thermiques et ce que sont? (Avec des exemples)Le premier modèle atomique est attribué à Leucipo et à son disciple démocrite d'Abdera (460 à. C. - 370 A. C.). Dès le premier petit, il est connu, mais le démocrite était une sauge de grande renommée, comparable à Platon et Aristote, bien que quelques fragments de son travail soient à peine préservés.
Democritus a conçu l'atome comme la particule ultime qui forme la question, indivisible et indestructible. Selon leurs théories, toute la matière était composée de ces particules, trop petites pour être vues. Et selon la manière de la combinaison, les atomes ont fourni au sujet leurs propriétés caractéristiques.
Contrairement à cela, après avoir commenté. Les idées continues d'Aristote ont finalement prévalu jusqu'au début du 19e siècle.
Les œuvres de Dalton
En 1793, John Dalton était intéressé par la météorologie et a continué à travailler dans l'étude des gaz atmosphériques et de leurs propriétés. Grâce à ses expériences, il s'est rendu compte que des éléments comme l'oxygène, toujours combinés dans une certaine proportion, donnés par un entier.
En 1803, Dalton a expliqué que ces proportions sont dues au fait que la question est composée de particules de base, appelées atomes, comme l'a dit Democrit il y a longtemps. Il a présenté sa proposition dans l'œuvre "New System of Chemical Philosophy", dans lequel il a décrit les résultats de ses expériences.
De plus, dans la mesure où les travaux comprenaient également des symboles spéciaux pour représenter les atomes individuels de chaque élément, jetant ainsi les fondements de la chimie moderne.
Peut vous servir: sons aigus: caractéristiques et exemplesExplication du modèle atomique Dalton
Pendant la période où Dalton a développé son travail, d'autres scientifiques avaient déjà découvert certaines des lois qui régissent le sujet et les combinaisons entre les éléments: Antoine Lavoisier a établi que, lors d'une réaction chimique, la masse n'est pas créée ou détruite, mais cela devient.
Cette loi a été suivie par la loi de Proust dans les proportions définies, établissant que, lorsque deux éléments sont combinés, ils le font toujours dans des proportions fixes.
Maintenant, une partie des expériences de Dalton a consisté à étudier l'absorption de l'eau dans l'eau. Là, il a observé qu'un certain volume d'eau ne pouvait absorber qu'une certaine quantité de gaz, et que cette quantité variait en fonction du gaz. De plus, le gaz pourrait être récupéré de l'eau, en gardant ses propriétés intactes.
Il avait également découvert que lorsque deux éléments peuvent être combinés pour créer plus d'un composé, la quantité de chacun reste fixe et maintient une relation numérique simple, par exemple 1: 1, 1: 2; 2: 3 et ainsi de suite. C'est l'appel Loi des proportions multiples.
Pour expliquer ces faits, Dalton a fait valoir que le gaz, l'eau et en général, toute la matière, se compose de pièces de base qui, lorsqu'elles sont combinées, donnent naissance à différents composés. Chaque élément se compose de particules distinctives (Dalton ne les a pas appelés atomes au début), mais même en combinaison, ces particules maintiennent leurs qualités inchangées.
Le modèle atomique de Dalton postule
Le modèle atomique de Dalton est résumé dans les déclarations suivantes:
1. La matière est constituée par de minuscules particules indivisibles appelées atomes.
2. Chaque élément se compose d'atomes identiques les uns avec les autres et avec des propriétés égales. Les atomes d'un élément diffèrent de ceux des autres.
3. En rejoignant deux ou plusieurs atomes d'éléments différents, ils le font dans certaines proportions simples, créant ainsi les composés, formés par des molécules. Les molécules d'un certain composé sont identiques.
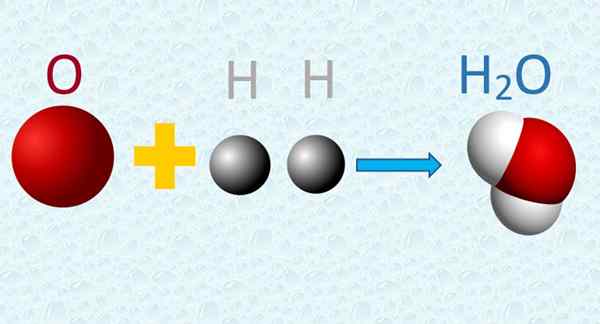 Dans une molécule d'eau, l'oxygène et les atomes d'hydrogène sont combinés dans des proportions simples. Source: F. Zapata.
Dans une molécule d'eau, l'oxygène et les atomes d'hydrogène sont combinés dans des proportions simples. Source: F. Zapata. 4. Pendant une réaction chimique, les atomes sont échangés, mais ils ne souffrent d'aucune transformation, et ils ne sont pas créés ou détruits dans le processus.
Échecs du modèle Dalton
La recherche scientifique a connu un boom remarquable au cours du XIXe siècle, promu par la révolution industrielle. Et les principaux échecs du modèle atomique de Dalton n'ont pas été révélés:
Peut vous servir: Tension interfaciale: définition, équation, unités et mesure1. L'atome n'est pas indivisible
C'est l'une des échecs les plus importants du modèle atomique de Dalton. Les expériences réalisées au cours des XIXe et XXe siècles ont montré que l'atome est composé d'une multitude de particules subatomiques.
Les premiers à se connaître étaient l'électron et le proton, et plus tard, il a été appris sur l'existence du neutron. Ensuite, le proton et le neutron ont révélé sa structure interne.
2. Les atomes du même élément peuvent ne pas être identiques
Les éléments ont des isotopes qui, bien qu'ils aient les mêmes propriétés chimiques, diffèrent dans le nombre de neutrons, donc leur poids atomique est différent. Par exemple, les isotopes d'hydrogène sont la protio, le deutérium et le tritium.
3. Les atomes ne sont pas invariables
Il existe des substances radioactives qui émettent des particules et de l'énergie, se transformant en autres éléments.
4. Les atomes ne se combinent pas toujours dans des proportions entières
Il est prouvé qu'il existe des composés organiques et plus complexes, qui ne suivent pas exactement la loi de Dalton aux proportions multiples.
Articles d'intérêt
Modèle atomique Schrödinger.
Modèle atomique broglie.
Modèle atomique de Chadwick.
Modèle atomique Heisenberg.
Modèle atomique perrin.
Modèle atomique Thomson.
Modèle atomique de Dirac Jordan.
Modèle atomique démocrite.
Modèle atomique de leucipo.
Modèle atomique bohr.
Modèle atomique de Rutherford.
Modèle atomique actuel.
- « Les 50 écrivains mexicains les plus célèbres de l'histoire
- Différences entre la science et la technologie »

