Structure métoxyétane, propriétés, objets d'obtention, utilisations, risques
- 2017
- 387
- Prof Ines Gaillard
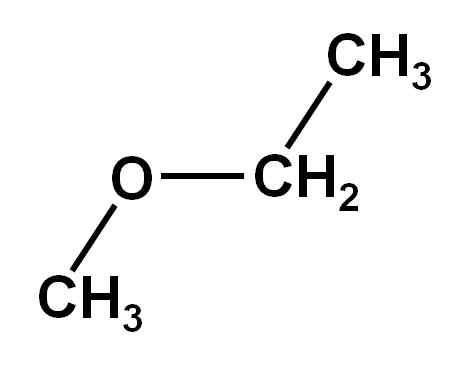
Il Métoxyétan C'est un composé organique de la famille d'éthers ou d'alcoxydes. Sa formule chimique est Cho3Och2Ch3. Il est également appelé éther méthyl etil ou éther d'éthyle méthylique. C'est un composé gazeux à température ambiante et sa molécule présente deux groupes méthyl -ch3, l'un attaché directement à l'oxygène et l'autre appartenant à l'éthyl -ch2Ch3.
Metoxietano est un gaz incolore, soluble dans l'eau et miscible avec de l'alcool éthérique et de l'alcool. Être un éther est un petit composé réactif, cependant, il peut réagir à des températures élevées avec certains acides concentrés.
 Métoxietano ou éther méthylique. Auteur: Marilú Stea
Métoxietano ou éther méthylique. Auteur: Marilú Stea Il est généralement obtenu par la synthèse de Williamson SOP, qui comprend l'utilisation d'un alcoxyde de sodium et d'un iodure d'alkyle. À son tour, sa décomposition a été étudiée dans plusieurs conditions.
Le métoxietano est utilisé dans les laboratoires de recherche avec divers objectifs, par exemple, dans l'étude des nanomatériaux semi-conducteurs ou dans l'observation de la matière interstellaire dans les constellations et les grands nuages moléculaires de l'univers.
En fait, grâce à des télescopes très sensibles (interféromètres), il a été détecté dans certains endroits d'espace interstellaire.
[TOC]
Structure
Le composé métoxyétan a un groupe méthyle -ch3 et un groupe éthylique -ch2Ch3 tous deux attachés à un oxygène.
Comme on peut le voir, dans cette molécule, il existe deux groupes méthyle, un attaché à l'oxygène Cho3-O et l'autre appartenant à l'éthyl -ch2-Ch3.
Dans l'état d'énergie fondamentale ou inférieure, le groupe méthyle de -ch2-Ch3 est en position trans En ce qui concerne le méthyle attaché à l'oxygène, c'est-à-dire dans un endroit diamétralement opposé, en prenant comme référence le lien CHO2-SOIT. C'est pourquoi on l'appelle parfois trans-Éther à éthyle méthylique.
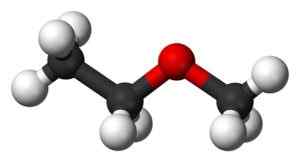 Structure de l'éther trans-méthyl méthylique en 3D. Carbone noir. Blanc: hydrogène. Rouge: oxygène. Le lien entre l'oxygène et -ch2- peut tourner, auquel cas les deux -ch3 Ils seraient plus proches les uns des autres. Ben Mills et Jynto [domaine public]. Source: Wikipedia Commons.
Structure de l'éther trans-méthyl méthylique en 3D. Carbone noir. Blanc: hydrogène. Rouge: oxygène. Le lien entre l'oxygène et -ch2- peut tourner, auquel cas les deux -ch3 Ils seraient plus proches les uns des autres. Ben Mills et Jynto [domaine public]. Source: Wikipedia Commons. Cette molécule peut ressentir une torsion dans le lien Cho2-Ou, qui place le méthyle dans une position spatiale différente de la trans , Groupes méthyl -ch3 Ils sont très proches les uns des autres et cette torsion génère une transition d'énergie détectable par des instruments sensibles.
Peut vous servir: Coulombimétrie: fondamentaux, types, applicationsNomenclature
- Métoxyétan.
- Éther de méthyl.
- trans-Ether méthylique Ethil (principalement en littérature anglophone, traduction en anglais trans-Éther à éthyle méthylique).
Propriétés physiques
État physique
Gaz incolore
Poids moléculaire
60 096 g / mol
Point de fusion
-113,0 ºC
Point d'ébullition
7,4 ºC
Point d'inflammation
1,7 ºC (méthode de tasse fermée).
Température d'auto-direction
190 ºC
Poids spécifique
0,7251 à 0 ºC / 0 ºC (il est moins dense que l'eau mais plus lourd que l'air).
Indice de réfraction
1 3420 à 4 ° C
Solubilité
Eau soluble: 0,83 moles / L
Soluble en acétone. Miscible avec de l'alcool éthylique et de l'éther éthylique.
Propriétés chimiques
Metoxietano est un éther, il est donc relativement peu réactif. L'Union de carbone-oxygène-carbone C-O-C est très stable devant les bases, les agents oxydants et les réducteurs. Il ne produit que sa dégradation acide, mais il ne se produit que dans des conditions vigoureuses, c'est-à-dire avec des acides concentrés et des températures élevées.
Cependant, il a tendance à s'oxyder en présence de peroxydes instables d'air. Si les conteneurs le contenant au chauffage ou au feu sont exposés, les conteneurs exploitent violemment.
Décomposition de la chaleur
Lorsque le métoxyétan est soumis à un chauffage entre 450 et 550 ° C est décomposé en acétaldéhyde, éthane et méthane. Cette réaction est catalysée par la présence d'iodure d'éthyle, qui est généralement présent dans des échantillons de métoxyétane de laboratoire car il est utilisé dans son objet.
Décomposition photosensibilisée
Le métoxyéthane irradié avec une lampe à vapeur de mercure (longueur d'onde de 2537 Å) se décompose générant une grande variété de composés parmi lesquels se démarquent: l'hydrogène, 2,3-dimétoxibtano, 1-éthoxy-2-métoxipropane et méthyle vinyle éther éther éther éther éther éther.
Les produits finaux dépendent du temps d'irradiation de l'échantillon, car en poursuivant l'irradiation qui forme initialement de nouveaux composés.
En prolongeant le temps d'irradiation, ils peuvent également se former: propane, méthanol, éthanol, acétone, 2-butanone, monoxyde de carbone, éther éthyl-n-pro-propy.
Obtention
Parce qu'il s'agit d'un éther non symétrique, le métoxyéthane peut être obtenu par la réaction entre le métoxyde de sodium ch3Ona et le yoduro de etilo ch3Ch2Toi. Ce type de réactions s'appelle la synthèse de Williamson.
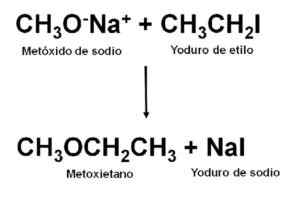 Obtention de Metoxietano à travers la synthèse de Williamson. Auteur: Marilú Stea.
Obtention de Metoxietano à travers la synthèse de Williamson. Auteur: Marilú Stea. Une fois la réaction réalisée, le mélange est distillé pour obtenir l'éther.
Peut vous servir: composés ternaires: caractéristiques, formation, exemplesIl peut également être obtenu en utilisant de l'éthoxyde de sodium ch3Ch2Ona et sulfate de méthyle (ch3)2Swin4.
Emplacement dans l'univers
Il trans-L'éther méthylique Ethil a été détecté dans la moitié interstellaire dans des régions telles que la constellation d'Orion KL et dans le nuage moléculaire géant W51E2.
 Orion Constellation où des nuages moléculaires sont observés. Rogelio Bernal Andreo [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikipedia Commons.
Orion Constellation où des nuages moléculaires sont observés. Rogelio Bernal Andreo [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikipedia Commons. La détection de ce composé dans l'espace interstellaire ainsi que l'analyse de son abondance sont utiles pour la construction de modèles de chimie interstellaire.
Utilisation du métoxyétan
Le métoxietano ou l'éther méthyl éther est principalement utilisé dans les expériences de laboratoire pour la recherche scientifique.
Pour des études sur la matière interstellaire
Étant une molécule organique avec des rotations internes, le metoxietano est un composé chimique d'intérêt pour les études de matière interstellaire.
Les rotations internes de leurs groupes méthyle produisent des transitions d'énergie dans la région micro-ondes.
Par conséquent, ils peuvent être détectés par des télescopes très sensibles tels que le grand ensemble millimétrique / submylimétrique d'Atacama, ou Soul (acronyme pour l'anglais ATACAMA GRAND Millimètre / SubmilliMet).
 Apparition d'une partie du grand observatoire astronomique d'Alma. ESO / JOSÉ FRANCISCO SALGADO (JOSEFRANCISCO.org) [cc par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)]. Source: Wikipedia Commons.
Apparition d'une partie du grand observatoire astronomique d'Alma. ESO / JOSÉ FRANCISCO SALGADO (JOSEFRANCISCO.org) [cc par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)]. Source: Wikipedia Commons. Grâce à sa rotation interne et aux grands observatoires spatiaux trans-L'éther de méthyl Ethil a été trouvé dans la constellation d'Orion et dans le nuage moléculaire géant W51E2.
À déduire les transformations chimiques dans divers domaines d'étude
Certains chercheurs ont observé la formation de métoxyétano ou d'éther méthyl éthylique lorsqu'un mélange d'éthylène CH est rayonné d'électrons2= Ch2 Et métanol ch3Oh.
Le mécanisme de la réaction passe par la formation du ch radical3Ou •, qui attaque la double liaison riche en électrons Cho2= Ch2. L'adduit résultant ch3-O-ch2-Ch2• capturer un hydrogène à partir d'un cho3Oh et forme l'éther méthyl etil cho3-O-ch2-Ch3.
L'étude de ce type de réactions d'irradiation électronique est utile dans le domaine de la biochimie car il a été déterminé que les dommages à l'ADN peuvent causer ou dans le domaine de la chimie organométallique car il favorise la formation de nanostructures.
Peut vous servir: précipiterDe plus, il est connu que de grandes quantités d'électrons secondaires sont produites lorsque le rayonnement électromagnétique ou des particules interagit avec la matière condensée dans l'espace.
Par conséquent, on estime que ces électrons peuvent initier des transformations chimiques en matière de poudre interstellaire. D'où l'importance d'étudier l'éther méthyl Ethil dans ces réactions.
Utilisation potentielle dans les semi-conducteurs
Grâce à des méthodes de calcul de calcul, certains scientifiques ont constaté que le méthoxyéthane ou l'éther méthylique peut être adsorbé par du graphène baissé de gallium (GA) (remarquez quelle adsorption est différente de l'absorption).
Le graphène est un nanomatériau formé d'atomes de carbone qui sont disposés formant un motif hexagonal.
 Vue microscopique du graphène. Maido Merisalu [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons.
Vue microscopique du graphène. Maido Merisalu [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons. L'adsorption du métoxyétan sur le graphène baissé se produit par l'interaction entre l'oxygène de l'éther et l'atome de gallium qui est à la surface du nanomatériau. En raison de cette adsorption, il y a un transfert de charge nette de l'éther au gallium.
Après l'adsorption de l'éther de méthyl éthylique et en raison de ce transfert de charge, le graphène baissé de gallium présente les propriétés du semi-conducteur de type P.
Des risques
Metoxietano est très inflammable.
En restant en contact avec l'air, il a tendance à former des peroxydes instables et explosifs.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Éther à éthyle méthylique. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement.
- Irvine W.M. (2019) Ether d'ethhyl méthyl (c2H5Och3). Dans: Gargaoud m. et al. (Eds). Encyclopédie de l'astrobiologie. Springer, Berlin, Heidelberg. Lien récupéré.Springer.com.
- Troisième B. et al. (2015). Recherche d'éthyl méthyl eter trans dans Orion KL. Astronomie et astrophysique. 582, L1 (2015). NCBI a récupéré.NLM.NIH.Gouvernement.
- Filseth, s.V. (1969). Le Mercure 6 (3P1) Décomposition photosensibilisée de l'éther de méthyl ethher. Le Journal of Physical Chemistry. Volume 73, numéro 4, avril 1969, 793-797. Récupéré des pubs.ACS.org.
- Casanova, J.JR. (1963). Préparation et manipulation des élèves de l'éther de l'essence à gaz-méthyle. Journal of Chemical Education. Volume 40, numéro 1, janvier 1963. Récupéré des pubs.ACS.org.
- Ure, w. Et jeune, J.T. (1933a). Sur le mécanisme des réactions gazeuses. Toi. La décomposition thématique de l'éther méthyl éthylique. The Journal of Physical Chemistry, Vol. Xxxvii, non.9: 1169-1182. Récupéré des pubs.ACS.org.
- Ure, w. Et jeune, J.T. (1933b). Sur le mécanisme des réactions gazeuses. Ii. Catalyse homogène dans la décomposition de la méthode ethher ethher. The Journal of Physical Chemistry, 37, 9, 1183-1190. Récupéré des pubs.ACS.org.
- Shokuhi rad, un. et al. (2017). Étude DFT sur l'adsorption des éthers diéthyliques, d'éthhyl méthyl et de diméthyl à la surface du graphène dopé au gallium. Science de la surface appliquée. Volume 401, 15 avril 2017, pages 156-161. Récupéré de ScienceDirect.com.
- Schmidt, F. et al. (2019). Formation induite par des électrons d'éther éthyl méthylique dans des mélanges condensés de méthanol et d'éthylène. J. Chèque. Chem. A 2019, 123, 1, 37-47. Récupéré des pubs.ACS.org.
- « Les 60 meilleures phrases de dentistes
- Caractéristiques de moutons, types, exemples d'utilisations »

