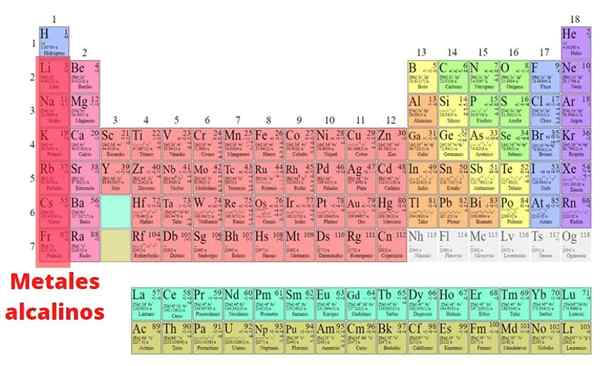
Métaux alcalins Propriétés physiques et chimiques, utilisations, obtenant
- 950
- 16
- Justine Charpentier
Les métaux alcalins Ce sont les éléments qui font partie du groupe I du tableau périodique, à l'exception de l'hydrogène: lithium (LI), sodium (NA), potassium (k), rubidid. Contrairement à la plupart des métaux, ils ont de faibles densités et sont très réactifs. En raison de cette grande réactivité chimique, ils ne sont jamais trouvés dans la nature sous leur forme élémentaire.
Ces métaux forment des composés ioniques simples et stables qui, pour la plupart, sont solubles dans l'eau; Les métaux alcalins sont généralement combinés avec des ions halogénide, sulfate, carbonate et silicate. Cependant, certains éléments forment un nombre limité de composés complexes et organométaux.

En général, les propriétés physiques et chimiques des métaux alcalins ont été bien étudiés, à l'exception de Francio en raison de sa nature radioactive.
[TOC]
Propriétés physiques
- Les métaux alcalins sont en argent, à l'exception du césium, qui est doré. Ils conduisent l'électricité et la chaleur, et ont de faibles points de fusion qui diminuent également avec l'augmentation du nombre atomique, car le lien entre les atomes est affaibli en augmentant le rayon atomique.
- Le fait d'avoir un seul électron de Valencia par Atom rend également sa liaison métallique faible. Par conséquent, les métaux alcalins sont également suffisamment mous pour les couper avec un couteau ou une spatule.
- Tous les éléments adoptent une structure cubique centrée sur le corps. Parce que ce type de structure cristalline n'est pas emballé et que les radios atomiques des métaux alcalins sont grandes, ils ont de faibles densités par rapport aux autres métaux. En fait, le lithium, le sodium et le potassium flottent dans l'eau.
- Les différences d'énergie entre les orbitales de la couche de valence des métaux alcalines coïncident avec des longueurs d'onde de lumière visible. Pour cette raison, lors du chauffage des composés formés par ces métaux dans une flamme, des couleurs caractéristiques sont générées.
Il peut vous servir: trinitrotolueno (TNT): structure, propriétés, utilisations, risques, explosion- En ordre décroissant, les sels de lithium donnent une couleur cramoisie, les sels de sodium une couleur jaune, le potassium une couleur violette, le rubidium une couleur rouge bleuâtre et cesser une couleur bleue.
Propriétés chimiques
Tous les métaux alcalins ont des similitudes dans leurs propriétés chimiques.
- Ils ont une configuration électronique de Valencia NS1, ce qui se traduit par un état d'oxydation +1. À son tour, cela signifie qu'ils perdent facilement un électron pour obtenir une configuration de gaz noble.
- En général, les métaux alcalins ont les énergies d'ionisation les plus basses de tous les éléments, qui diminuent également à mesure que le rayon atomique augmente au sein du groupe car la couche de valence est de plus en plus éloignée du noyau. Cela explique la réactivité des métaux alcalins et la formation d'ions M + dans des conditions facilement aqueuses.
- La tendance thermodynamique à former les ions M + est confirmée par les potentiels standard des paires M + / M, qui sont tous grands et négatifs. Une telle tendance implique que les métaux alcalins s'oxydent facilement et peuvent agir comme des agents réducteurs puissants.
- Ces éléments doivent être stockés dans une huile non réactive pour éviter la réaction avec l'oxygène atmosphérique. Bien que le lithium, le sodium et le potassium puissent être manipulés dans l'air pendant de courtes périodes, le rubidium et le césium doivent être manipulés sous une atmosphère inerte à tout moment.
Obtenir des métaux alcalins
Sodium

La meilleure façon d'obtenir du sodium métallique implique l'électrolyse du chlorure de sodium fondu. Parce que le point de fusion du chlorure de sodium est assez élevé (808 ° C) et beaucoup d'énergie est nécessaire pour maintenir de grandes quantités de substance foncière, le chlorure de calcium (CACL2) est généralement ajouté pour réduire le point de fusion à environ 600 ° C.
Peut vous servir: turbidimétrieLe sodium est obtenu à l'état liquide de la cathode avec une pureté de 99,95% sous une atmosphère inerte.
Lithium et potassium
Le lithium peut également être obtenu à partir de ses chlorures coulés par électrolyse, mais ce n'est pas le cas du potassium car il est trop soluble dans le chlorure (KCl) et ne flotte pas à la surface de la cellule. De plus, il s'évapore facilement à la température de fonctionnement, il crée donc des conditions dangereuses.
Par conséquent, le potassium est obtenu par réduction du KCl fondu avec du sodium liquide. Le sodium présent dans le potassium est éliminé en condensant la vapeur à 892 ° C et en effectuant une distillation fractionnée des métaux liquides.
Rubidio et Cesio
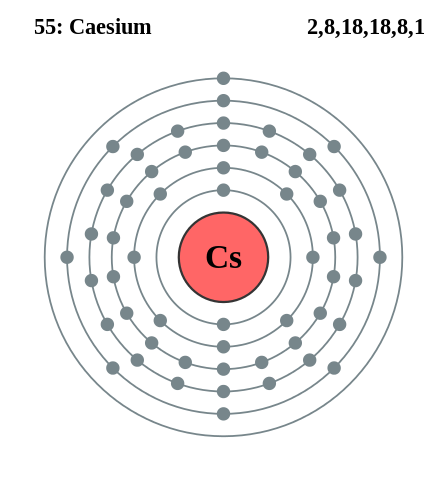 Configuration de césium électronique. Source: Pumbaa (travail original de Greg Robson) / CC BY-SA 2.0 Royaume-Uni (https: // CreativeCommons.Org / licences / by-sa / 2.0 / Royaume-Uni / Deed.dans)
Configuration de césium électronique. Source: Pumbaa (travail original de Greg Robson) / CC BY-SA 2.0 Royaume-Uni (https: // CreativeCommons.Org / licences / by-sa / 2.0 / Royaume-Uni / Deed.dans) Rubidio et le césium peuvent être obtenus de manière similaire, mais en utilisant le calcium comme agent réducteur. Le catesse métallique peut également être obtenu par électrolyse du cyanure de césium fondu (CSCN).
Utilisations et applications principales
Sodium comme agent réducteur
Comme le sodium est très facilement oxydé, son application la plus importante est en tant qu'agent réducteur pour obtenir des métaux tels que le titane, le surround et le hafnio. Il est également utilisé comme échangeur de chaleur dans les réacteurs nucléaires à l'état liquide.
Potassium comme engrais
 Chlorure de potassium, engrais. Source: Abbas Cucaniensis / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)
Chlorure de potassium, engrais. Source: Abbas Cucaniensis / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0) La plupart du potassium traité va aux engrais sous forme de chlorure de potassium. À son tour, le chlorure est utilisé dans la production d'autres composés et solutions tels que l'hydroxyde de potassium, qui est utilisé dans la fabrication de savons liquides.
Le cyanure de potassium est utilisé pour l'extraction ou le revêtement métallique pour faciliter le dépôt de cuivre, d'argent et d'or. Le potassium peut également être trouvé dans certains explosifs et en tant que colorant des feux d'artifice.
Peut vous servir: radio: structure, propriétés, utilisations, obtentionLithium comme agent en alliage
Le lithium métallique est utilisé comme agent en alliage dans la production d'alliages aéronautiques et aérospatiaux en aluminium et en magnésium. Mais avec le temps, il a trouvé une utilité croissante comme une anode de batterie alcaline.
Le lithium métallique permet également de réduire les températures de fusion et de frittage de certains types de verre et de céramique, en plus de diminuer son coefficient d'expansion. Le carbonate de lithium est largement utilisé pour traiter les conditions bipolaires, tandis que le stéarate de lithium est un lubrifiant largement utilisé dans l'industrie automobile.
Rubidio et Cesio
Rubidio et césium sont généralement utilisés dans les mêmes applications, de sorte que l'un de ces éléments peut être remplacé par l'autre. Les applications incluent le verre à fibre optique dans l'industrie des télécommunications, l'équipement de vision nocturne et les cellules photoélectriques. L'horloge CESIO (horloge atomique) est utilisée pour la mesure temporelle standard internationale et pour la définition du second.
Les références
- Chang, R., & Goldsby, k. POUR. (2016). Chimie (12e érigé.). New York: Mc-Graw Hill.
- Halka, m., & Nordstrom, B. (2010). Métaux de la Terre alcalins et alcalins. New York: Publication d'infobase.
- Miesler, G. L., Fischer, P. J., & Tarr, D. POUR. (2014). Chimie inorganique (5e érigé.). New York: Pearson.
- Mishra, b., & Majumdar, G. (2017). Production de métaux alcalins (Li, Na, K). Module de référence dans la science des matériaux et l'ingénierie des matériaux. Elsevier.
- Petrucci, R. H., Hareng, f. g., Bissonnette, C., & Mature, J. D. (2017). Chimie générale: principes et applications modernes (11e érigé.). New York: Pearson.
- Shriver, D., Weller, m., Overton, t., Rourke, J., & Armstrong, f. (2014). Chimie inorganique (6e érigé.). New York: W. H. Homme libre.
- « Dans lequel le continent il y a une plus grande concentration de population?
- Caractéristiques, périodes, outils et inventions de l'âge du bronze »

