Fondation à moitié Cary Blair, préparation et utilisations
- 723
- 16
- Prof Ines Gaillard
Il À moitié Cary Blair Il s'agit d'une gélose semi-solide, utilisée pour le transport et la conservation d'échantillons biologiques qui abritent des agents pathogènes intestinaux, des micro-organismes labiles et anaérobies. Comme tout moyen de transport, sa fonction est de garder l'échantillon dans des conditions optimales jusqu'à ce qu'il soit cultivé. Les micro-organismes pathogènes présents, ainsi que le microbiote qui l'accompagne doit rester viable, mais sans augmenter leur population.
Le Cary Blair Media est le résultat du changement de formulation du transport Stuart. La modification a été apportée en 1964 et consistait à remplacer le système de régulation du pH (glycéophosphate) par un tampon inorganique inorganisé.
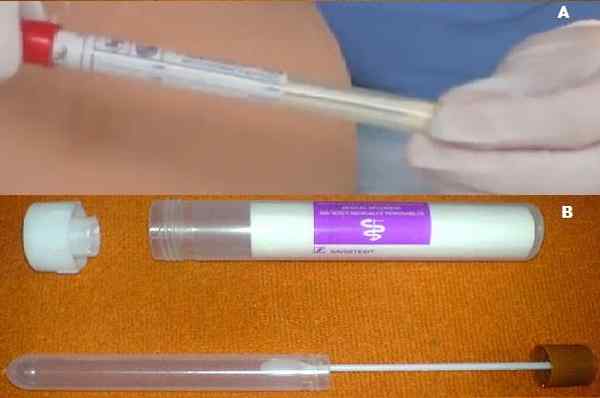
 POUR. Culture avec à moitié Cary Blair B. Collection de selles avec à moitié Cary Blair. Source: A. Vidéo meganhow, obtenez la culture de la culture 2011 youtube.peigne. Utilisateur: Mattes [Domaine public]
POUR. Culture avec à moitié Cary Blair B. Collection de selles avec à moitié Cary Blair. Source: A. Vidéo meganhow, obtenez la culture de la culture 2011 youtube.peigne. Utilisateur: Mattes [Domaine public] La reformulation était nécessaire car ses créateurs ont réalisé que le glycéophosphate après un certain temps pouvait être métabolisé par certaines bactéries saprophytes. Ceux-ci lors de la multiplication chevauchent les agents pathogènes actuels.
D'autres changements ont été l'élimination du bleu de méthylène, ainsi qu'un réajustement du pH vers l'alcalinité (pH 8,4). Tous ces changements ont amélioré l'efficacité des moyens de transport.
À l'origine, le cary Blair moyen a été utilisé pour le maintien d'agents pathogènes intestinaux, tels que Shigella flexneri, Salmonella SP, Vibrio cholerae et Campylobacter sp.
Cependant, par la suite, l'efficacité de la conservation de la viabilité des micro-organismes pathogènes exigeants et labiles a été observé, tel que: Neisseria gonorrhoeae, Haemophilus influenzae, Neisseria meningitidis, Bordetella pertussis, Streptococcus pneumoniae et quelques anaérobies.
[TOC]
Base
Le cary Blair moyen contient du chlorure de sodium, du tioglycoate de sodium, du phosphate de disodium, du chlorure de calcium et de la gélose.
Le chlorure de sodium maintient l'équilibre osmotique du milieu, le phosphate de disodium et le chlorure de calcium équilibrent le pH. Pour sa part, le tioglycelate de sodium maintient un faible potentiel de réduction de l'oxyde, tandis que la partie petite gélose fournit la consistance semi-solide.
Peut vous servir: d'où les hominidés sont-ils nés?Le moyen Cary Blair ne contient pas de substances nutritionnelles, car la fonction d'un moyen de transport est de maintenir l'échantillon sans les mêmes modifications en termes d'humidité et de charge microbienne; c'est-à-dire qu'il évite la déshydratation de l'échantillon conservant la viabilité et la quantité des micro-organismes présents.
Enfin, le pH légèrement alcalin évite la mort de micro-organismes dus à l'acidité, en particulier les vibrations sont très sensibles aux acides.
préparation
Les médias Cary Blair peuvent être achetés commercialement en tant qu'appareil spécial prêt à l'emploi. Le système de transport est recouvert d'un sac de pelage en plastique. À l'intérieur, il contient un écouvillonnage pour la collection de l'échantillon et le tube de conteneur du milieu semi-solide de Cary Blair.
Sur le marché, il existe également des maisons commerciales qui fournissent le milieu déshydraté pour leur préparation en laboratoire.
Pour ce faire, malgré 13,2 GR du milieu déshydraté et se dissoudre dans un litre d'eau distillée. Préparation chaude et secouer jusqu'à ce que vous dissoudiez complètement. Distribuez le milieu dans les tubes à essai avec le couvercle du filetage (Bquellita).
Soumettez les tubes de vapeur d'eau pendant 15 minutes. Laisser refroidir et garder à température ambiante jusqu'à utilisation.
Le moyen Cary Blair sans inoculation peut être conservé dans des conditions optimales jusqu'à 18 mois à température ambiante.
Le pH moyen doit être ajusté à 8,4 ± 0,2. La couleur du milieu préparé est beige, avec une certaine opalescence.
Utiliser
Type d'échantillons
Le moyen Cary Blair est utilisé lorsqu'il y a l'impossibilité de traiter immédiatement les échantillons de selles, les écouvillons rectaux et vaginaux.
Lorsqu'il n'est pas possible d'avoir un moyen de transport, les échantillons peuvent être conservés à -70 ° C.
Peut vous servir: organes lymphoïdes primairesPrise d'échantillon
L'écouvillon est imprégné de l'échantillon et il est introduit dans les médias Cary Blair, sans atteindre le fond.
Identification des échantillons
Le moyen Cary Blair doit avoir une étiquette dans laquelle les données de base sont placées, telles que: nom et nom de famille du patient, numéro d'identification de l'échantillon, source de l'échantillon, traitement du médecin, date et heure de la prise d'échantillon, diagnostic présumé, traitement antibiotique.
Transfert
Il couvre bien et transporté à température ambiante dans le cas des échantillons fécaux. Alors que pour les échantillons vaginaux à la recherche de micro-organismes anaérobies, il est recommandé de transporter des échantillons à 4 ° C.
Dans tous les cas, le temps de transfert recommandé est de 4 à 6 heures, avec un maximum de 24 heures.
Si la présence de Campylobacter jejuni Dans les échantillons de selles et ceux-ci ne peuvent pas être traités en 24 heures, la conservation est recommandée en moitié Cary Blair à 4 ° C.
Enquêtes menées sur les moyens de transport Cary Blair
Plusieurs études ont montré que le milieu Cary Blair peut être conservé viable aux micro-organismes entéropathogènes du genre Shigella et Salmonella jusqu'à 49 jours après l'échantillon.
Pour sa part, Vibrio cholerae, Un autre pathogène intestinal important est capable de survivre pendant 22 jours, tandis que Yersinia pestis (L'agent causal de la peste bubonique et pneumonique) peut être récupéré après 75 jours.
Cependant, malgré la durabilité démontrée concernant la récupération de ces micro-organismes, il est recommandé que les échantillons prélevés soient transportés au milieu de Cary Blair au laboratoire le plus rapidement possible.
De même, une fois que l'échantillon a atteint le laboratoire, il doit être semé sans délai dans les moyennes respectives.
Peut vous servir: MesothelioD'un autre côté, le moyen Cary Blair en plus d'être utile pour le transport de micro-organismes facultatifs, est également recommandé pour des échantillons contenant des agents pathogènes anaérobies.
En ce sens, DeMarco et des collaborateurs en 2017 ont mené une étude intitulée: Survie des micro-organismes vaginaux dans trois systèmes de transport disponibles dans le commerce.
Ils ont démontré que les moyens de Cary Blair sont le meilleur moyen de transport pour la conservation et la récupération des micro-organismes anaérobies vaginaux. Ils ont également montré que le taux de récupération le plus élevé était atteint lorsque la température de transfert était de 4 ° C.
Par conséquent, il est conclu que la température de transport pour les écouvillons vaginaux (micro-organismes anaérobies) doit être effectué à 4 ° C. Alors que pour les échantillons fécaux à la recherche de micro-organismes facultatifs, la température idéale est environnementale.
Contrôle de qualité
Pour évaluer le contrôle de la qualité du transport du transport Blair, souches connues sous le nom Shigella Sonnei ATCC 11060, Salmonella choleraesuis ATCC 14028, Vibrio cholerae et Campylobacter SP.
Le milieu est inoculé avec la contrainte choisie et maintenue à température ambiante pendant 24 heures. Ensuite, ils sont semés dans les médias culturels correspondants. Dans tous les cas, une récupération satisfaisante du micro-organisme en question est attendue.
Les références
- DeMarco AL, Rabe LK, Austin MN, et al. Survie des micro-organismes vaginaux dans trois systèmes commerciaux disponibles Systèmes. Anaérobe. 2017; 45: 44-49.
- Wasfy M, Oyofo B, Elgindy A, Churilla A. Comparaison de la moyenne de conservation pour le stockage des échantillons de selles. J Clin Microbiol. Année mille neuf cents quatre-vingts-quinze; 33 (8): 2176-2178.
- Dan M, Richardson J, Miliotis MD, Koornhof HJ. Comparaison des médias de préservation et des contenons de frezing pour le stockage des spécimens de fèces. J Med Microbiol. 1989; 28 (2): 151-4.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. 5e ed. Pan -American Editorial S.POUR. Argentine.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique de Bailey & Scott. 12 ed. Pan -American Editorial S.POUR. Argentine.
- Conda pronadisa Laboratories. À moitié Cary Blair. Disponible sur: condalab.com
- Laboratoire de métrix. Cary Blair. Disponible sur: MetrixLab.mx

