Caractéristiques de Tunsen Munder, fonctions, exemples d'utilisation

- 3529
- 895
- Paul Dumas
Il Briquet bunsen Il s'agit d'un instrument de laboratoire capable de fournir une source de chaleur efficace et en toute sécurité à travers une flamme, qui est un produit de la combustion d'un gaz qui est généralement du méthane, ou un mélange de propane et de butane. Cet instrument lui-même est synonyme de science et de chimie.
Son nom est dû au chimiste allemand Robert Bunsen, qui était responsable, avec l'entraîneur Peter Desa, pour sa mise en œuvre et son amélioration basée sur un modèle déjà conçu par Michael Faraday. Ce briquet est petit et léger, il peut donc être pratiquement déplacé vers n'importe quel endroit où il y a une bouteille de gaz et des connexions optimales.
 Bunsen plus léger chauffant la solution d'un ballon. Source: Sally V / CC By-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)
Bunsen plus léger chauffant la solution d'un ballon. Source: Sally V / CC By-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0) Le briquet de Tunsen est illustré en action. Notez que le scénario n'est même pas celui d'un laboratoire. La flamme, le bleu, chauffe le contenu du flacon pour développer une réaction chimique, ou simplement pour dissoudre un solide plus rapidement. L'utilisation principale de cet instrument est donc celle de simplement chauffer une surface, un échantillon ou un matériau.
Cependant, le briquet Bunsen est également utilisé pour une grande variété de méthodes et de processus, tels que l'essai de flamme, la stérilisation, la distillation, la combustion et la décomposition. Depuis l'enseignement secondaire, il a été la cause de l'étonnement et des craintes des étudiants, de devenir plus tard un instrument de routine.
[TOC]
Histoire
Les origines de ce briquet emblématique remontent à 1854, dans l'un des laboratoires de l'Université de Heidelberg, où Robert Bunsen a travaillé. D'ici là, les installations de l'université avaient déjà un système de gaz et de tuyaux plus léger plus rudimentaire avec lequel ils ont effectué des expériences.
Cependant, ces briquets, conçus par Michael Faraday, ont généré des flammes très brillantes et "sales", ce qui signifie qu'ils ont déposé à la surface qui a joué des taches de charbon. Ces flammes, en plus de camoufler les couleurs qui ont libéré certaines substances lorsqu'elles ont été chauffées, n'étaient pas assez chaudes.
Ainsi, Robert Bunsen, avec l'entraîneur allemand, Peter Drag, a décidé de mettre en œuvre des améliorations dans les briquets de Faraday. Pour y parvenir, ils ont demandé que le gaz brûle avec un débit d'air plus élevé, plus élevé que celui qui était librement autour du laboratoire. De cette façon, le briquet Bunsen-Disaga est né.
Depuis lors, les laboratoires ont à portée de main un briquet qui vous permet d'obtenir une flamme beaucoup plus chaude et "propre". De plus, grâce à cela plus léger, les fondations ou les origines de la spectroscopie ont été établies.
Peut vous servir: carbonoïdes: éléments, caractéristiques et utilisationsCaractéristiques et parties du briquet de Tunsen
- Instrument
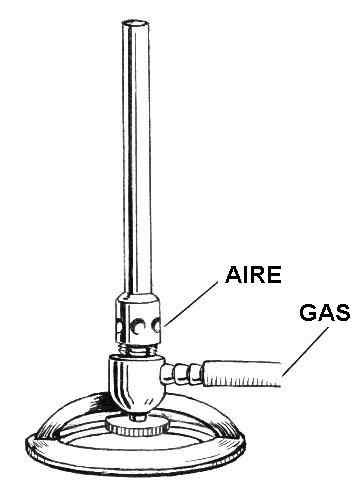 Dessin des parties du briquet Bunsen. Source: Foresman / domaine public de Pearson Scott / public
Dessin des parties du briquet Bunsen. Source: Foresman / domaine public de Pearson Scott / public Dans l'image supérieure, vous avez une illustration du briquet de Tunsesen. Les entrées respectives sont indiquées pour l'air et le gaz.
Le gaz se déroule à l'intérieur d'un tuyau en caoutchouc du robinet de gaz, situé dans la même auberge de laboratoire, jusqu'à l'entrée plus légère. Dans la zone inférieure du plus léger, juste au-dessus du support en forme d'anneau, une vanne ou une roue est située qui nivelle le débit de gaz qui sera hors de la buse de la briquet.
L'air, en revanche, entre dans le plus léger à travers les trous circulaires (ou rectangulaires) de son collier. Alors que le collier est cassé, plus d'air coulera à l'intérieur des trous et se mélangera avec le gaz. Ce mélange à gaz d'air s'élèvera le long du canon ou de la colonne, pour enfin sortir par la buse de la briquet.
Tout le plus léger dans son ensemble est fait d'un métal léger, comme l'aluminium, et sa taille est suffisamment petite pour être stockée sur n'importe quelle étagère ou tiroir.
- Appelle
Réducteur
 La flamme obtenue par le briquet Bunsen peut varier en couleur en fonction de la quantité d'air entrant. Source: Arthur Jankowski / CC BY-SA (http: // CreativeCommons.Org / licences / by-sa / 3.0 /)
La flamme obtenue par le briquet Bunsen peut varier en couleur en fonction de la quantité d'air entrant. Source: Arthur Jankowski / CC BY-SA (http: // CreativeCommons.Org / licences / by-sa / 3.0 /) Lorsqu'une source de chaleur est placée juste à la hauteur de la buse de briquet, que ce soit en utilisant une étincelle allumée ou une étincelle, le mélange de gaz d'air brûlera et la combustion commencera. Il apparaîtra alors la flamme. Cependant, les caractéristiques visuelles et chimiques de cette flamme dépendent du rapport Aire-Gas.
Si le collier est fermé, empêchant l'air entre ses trous, il y aura un mélange riche en gaz, qui brûlera avec l'oxygène de l'air environnant. Cette flamme correspond à la 1 (image supérieure), et est connue sous le nom de flamme "sûr" et "sale", pour être le moins chaud et celui qui produit également la plus grande quantité de suie. Notez à quel point il est brillant et aussi ses couleurs jaune-orange.
La luminosité de cette flamme est due au fait que les particules de suie, pratiquement composées d'atomes de carbone, absorbent la chaleur et le feu et la couleur et la couleur. Plus l'entrée en gaz est ouverte, plus cette flamme sera grande.
Cette flamme est également connue pour être un réducteur, car il fournit du carbone sous forme de particules de suie, qui sont capables de réduire certaines substances.
Oxydant
Alors que le collier tourne, les trous à travers lesquels l'air est ouvert, augmentant ainsi la quantité d'air dans le mélange gazeux résultant. En conséquence, la flamme jaune deviendra de plus en plus bleuâtre (de 2 à 4), à un point où elle peut sembler transparente si le fond et la pureté du mélange permettent.
Peut vous servir: thermique: structure, caractéristiques, formation, exemplesLe Flame 4 est le plus souhaité et utile en laboratoire, car il est le plus chaud et peut également parfaitement oxyder l'échantillon qui est placé à votre contact. Pour cette raison.
Fonctions / utilisations
 Éclairage de la tonnelle
Éclairage de la tonnelle D'après la section précédente, on peut conclure que la flamme est l'élément ou la caractéristique le plus important du briquet Bunsen. C'est en fait qui définit les fonctions ou utilisations respectives de cet instrument, qui ne sont en bref que de chauffer une surface, un matériau ou un échantillon.
Cependant, cela ne signifie pas qu'il peut être utilisé pour tout chauffer en laboratoire. Pour commencer, le point de fusion du matériau doit être supérieur à 1500 ºC, température maximale à laquelle la flamme peut atteindre. Sinon, il fondrait et provoquerait une catastrophe dans le Work Inn.
Deuxièmement, la température de la flamme est si élevée qu'elle est capable de régler les vapeurs de tout solvant organique, ce qui augmenterait les risques de feu. Par conséquent, seuls les liquides avec des points d'ébullition élevés et une faible volatilité doivent être chauffés.
C'est pour cette raison que l'eau est un exemple de liquide idéal pour chauffer à travers l'utilisation de Bunsen plus léger. Par exemple, il est généralement fréquent de chauffer les boules de distillation, de précipiter les vaisseaux, les flacons ou les pots, contenant des solutions aqueuses.
Utiliser des exemples
La combustion
L'une des principales utilisations du briquet Bunsen est de soumettre un échantillon à la combustion; c'est-à-dire l'oxyder rapidement et exothermique. Pour ce faire, la flamme oxydante (bleue et presque transparente) est utilisée et l'échantillon est placé à l'intérieur d'un récipient comme une fusion.
Cependant, la plupart des échantillons se déplacent par la suite dans une mufla, où vous pouvez continuer à vous réchauffer pendant des heures (même pendant une journée entière).
Décomposition thermique
Comme avec la combustion, en utilisant le briquet Bunsen. Cependant, cette méthode ne lui permet pas d'être surveillée par la progression de la décomposition au fil du temps.
Peut vous servir: diméthylanylin: structure, propriétés, synthèse, utilisationsRépétition des flammes
Les ions métalliques peuvent être détectés qualitativement par test de flamme. Pour ce faire, un fil auparavant chauffé et submergé dans l'acide chlorhydrique est mis en contact avec l'échantillon et est prélevé à l'intérieur de la flamme.
Les couleurs détachées aident à identifier la présence de métaux tels que le cuivre (vert bleuâtre), le potassium (violet), le sodium (jaune intense), le calcium (rouge orange), etc.
Stérilisation des matériaux
La chaleur de la flamme est telle qu'elle peut être utilisée pour une autre utilisation ingénieuse: pour détruire les micro-organismes à la surface des matériaux. Ceci est particulièrement utile lorsque vous traitez avec du verre ou des métaux qui sont destinés à des fins étroitement liées à la santé (aiguilles, pipettes, camarade, etc.).
Distillation
Il a été déjà dit que l'eau est l'un des liquides qui de préférence chauffés avec le briquet de Tunsesen. Pour cette raison, il est utilisé pour chauffer les boules de distillation, et ainsi faire bouillir l'eau afin que ses vapeurs traînent certaines essences ou parfums de matière végétale (pelures orange, poussière de cannelle, etc.).
D'un autre côté, il peut également être utilisé pour distiller d'autres types de mélanges, à condition que l'intensité de la flamme soit modérée et que trop de vapeurs sont générées dans le processus.
Détermination des points d'ébullition
Avec l'aide du tube Thiele, de l'huile, un soutien et une capilla. Cette expérience est assez courante dans les laboratoires d'enseignement de la chimie générale et de la chimie organique.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2020). Bec Bunsen. Récupéré de: dans.Wikipédia.org
- Intérêts composés. (31 mars 2016). Histoire de la chimie: Bunsen Burner Day. Récupéré de: Compoundchem.com
- Nikki Wyman. (31 août 2015). Burner Bunsen: pièces, fonction et diagramme. Récupéré de: étudier.com
- Nichols Lisa. (18 août 2019). Burners Bunsen. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Université d'État de Wayne. (s.F.). Utilisation appropriée d'un brûleur Bunsen. [PDF]. Récupéré de: Recherche.Wayne.Édu
- « Comment l'histoire est divisée? Étapes principales
- Les 101 photographes les plus célèbres et les plus reconnus »

