Hess Explication Law, Applications, Exemples
- 3698
- 997
- Adrien Remy
La Loi de Hess C'est une autre manifestation de la loi sur la conservation de l'énergie qui permet de déterminer, à travers de simples sommes algébriques, l'enthalpie d'une réaction chimique. Compris par l'enthalpie comme la chaleur libérée ou absorbée, à une pression constante, qui est associée à toute réaction chimique ou phénomène chimique.
Les enthalpies, ΔH, sont déterminés expérimentalement en utilisant la calorimétrie. Cependant, il y a des réactions difficiles à étudier avec cette technique. Lorsque cela se produit, d'autres réactions sont utilisées que leurs enthalpies spécifiques ont et qui possèdent les intérêts ou les composés qui intéressent.
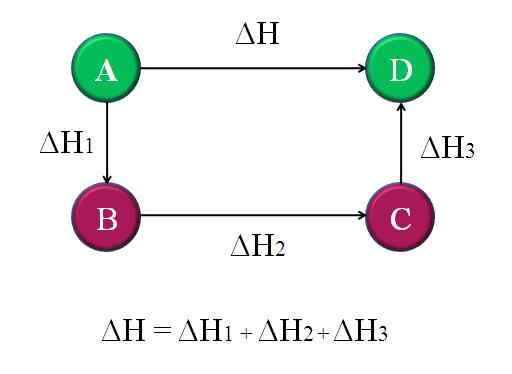
 Diagramme simple et général où la loi Hess pour quatre réactions chimiques est appliquée. Source: Gabriel Bolívar.
Diagramme simple et général où la loi Hess pour quatre réactions chimiques est appliquée. Source: Gabriel Bolívar. De cette façon, le ΔH «inconnu» de la réaction peut être calculé. Par exemple, le diagramme supérieur aide à comprendre cette idée. Il y a quatre réactions: A-D, A-B, B-C et C-D. La réaction A-D est celle qui a le plus grand ΔH, car ils se produisent, pour ainsi dire, les changements chimiques les plus notoires.
Les autres réactions, tout en étant plus petites ΔH, car elles se composent d'étapes alternatives ou de réactions alternées pour atteindre les mêmes produits D. Par conséquent, la somme de ΔH1, ΔH2 et ΔH3, Il sera égal à ΔH. Le savoir, ΔH, ou toute autre enthalpie, peut être calculé en appliquant des clairières simples. C'est la loi de Hess.
La loi de Hess est très utile lors du calcul des enthalpies de réaction, ainsi que de la formation des enthalpies pour différents composés ou intermédiaires instables.
[TOC]
Explication de la loi de Hess
Calcul de l'enthalpie d'une réaction
La raison pour laquelle il est accompli que:
ΔH = ΔH1 + ΔH2 + ΔH3
C'est parce que l'enthalpie, ou le changement d'enthalpie, est une fonction d'état. Cela signifie que leurs valeurs ne sont pas modifiées par le nombre d'étapes, étapes ou réactions intermédiaires. Par exemple, ΔH restera le même même lorsqu'il y a un ΔHdix qui doit être considéré dans la somme algébrique.
Les enthalpies pourraient être visualisés comme le sommet de certaines montagnes. Peu importe comment les étapes vers eux sont dirigées, la hauteur qui les sépare du niveau MAR ne variera jamais. Et c'est précisément les hauteurs qui sont ajoutées ou soustraites pour déterminer la hauteur inconnue d'une montagne environnante.
Retour au diagramme précédent: A, c'est une montagne, d'une autre montagne, et ainsi de suite. La différence de hauteur entre les sommets A et D est le plus grand. Ajout des hauteurs entre A-B, B-C et C-D, il donnera égal à la hauteur A-D. C'est ce qui est fait avec les enthalpies de leurs réactions chimiques respectives.
Peut vous servir: groupe de phosphateEnthalpie d'une réaction des enthalpies des formations
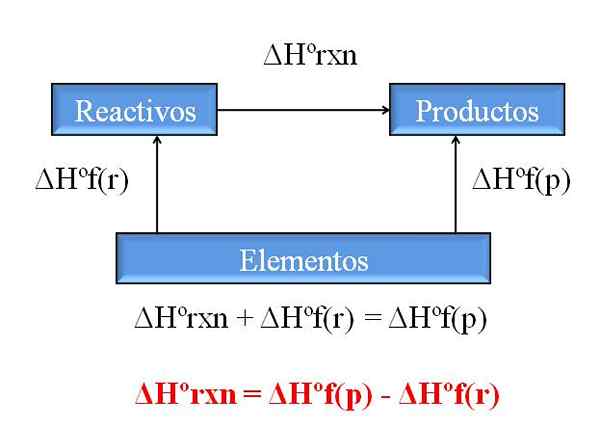 Diagramme général pour calculer l'enthalpie d'une réaction des enthalpies des formations. Source: Gabriel Bolívar.
Diagramme général pour calculer l'enthalpie d'une réaction des enthalpies des formations. Source: Gabriel Bolívar. L'une des conséquences les plus précieuses de la loi de Hess est qu'elle permet de déterminer les enthalpies de toute réaction chimique, en prenant les enthalpies de la formation de tous les composés (réactifs et produits) impliqués.
L'image supérieure illustre ce point. Compris par l'enthalpie de la formation de chaleur associée lorsqu'un composé est formé à partir de ses éléments. Cette enthalpie deviendrait la différence maximale possible entre les réactifs et les produits, sans avoir besoin de consulter d'autres réactions chimiques; Du moins, en dehors de la formation séparée des composés.
Comment lisez-vous le diagramme cette fois? Une astuce consiste toujours à ajouter les enthalpies lorsqu'il va dans le sens de la flèche et à les soustraire lorsque la flèche est sur la route opposée. Ainsi, ΔHºrxn, enthalpie de réaction standard, ajoute à ΔHºF (réactifs), enthalpie standard de la formation de réactifs, et ils sont soustraits ΔHºF (produits), enthalpie standard de la formation de produits des produits.
Réactions Summes
Les diagrammes peuvent devenir très compliqués à interpréter, surtout lorsqu'il existe de nombreuses réactions qui doivent être considérées. Par conséquent, la somme des réactions est utilisée. Cette méthode facilite considérablement le calcul des enthalpies et accélère la compréhension de la loi de Hess.
Supposons par exemple que vous souhaitez déterminer le ΔHºrxn de la réaction suivante:
A + B + C → ABC
Et nous avons également deux autres réactions:
A + B → AB (ΔHº1)
AB + C → ABC (ΔHº2)
Il est intéressant que A + B + C soit sur le côté gauche (réactifs) et qu'ABC est sur le côté droit (produits). Ensuite, nous procédons simplement à l'ajout des deux dernières réactions:
A + B → AB
AB + C → ABC
A + AB + C → ABC + AB
Comme AB est des deux côtés, il est éliminé. Et donc nous avons:
A + B + C → ABC
ΔHºrxn = ΔHº1 + Δhº2
Ajout des réactions, l'utilisation de tout diagramme est omise.
Applications de la loi de Hess
La loi de Hess permet, sans avoir besoin d'expériences, enthalpies pour différentes réactions chimiques ou phénomènes. Certains d'entre eux sont répertoriés:
- Trainer les enthalpies pour les composés ou les intermédiaires instables, comme nous l'avons habituellement en chimie organique.
-Enthalpies des transitions de phase, dans l'étude des solides cristallins.
Peut vous servir: composé chimique-Enthalpies des transitions allotropes, comme celle entre le graphite et le diamant.
De même, la loi de Hess est utilisée pour déterminer l'énergie réticulaire d'un solide et les affinités électroniques de certains atomes.
Exemples: exercices résolus
- Exemple 1
Calculez le ΔHrxn de la réaction suivante:
2hcl (g) + f2(g) → 2hf (l) + cl2(g)
Si vous avez les réactions suivantes et leurs enthalpies respectives:
4hcl (g) + ou2(g) → 2h2Ou (l) + 2cl2(g) (ΔH = -202.4 kJ / mol)
1/2h2(g) + 1 / 2F2(g) → hf (l) (ΔH = -600.0 kJ / mol)
H2(g) + 1/2O2(g) → H2Ou (l) (ΔH = -285.8 kJ / mol)
Commande d'équations
Pour commencer, nous devons ajouter les réactions de telle manière que HCl et F2 sont sur le côté gauche, et hf et cl2, Sur le côté droit. Mais plus important encore, il remarque que tant de h2 cendre2Ou ne sont pas dans l'équation d'intérêt. Par conséquent, nous devons les annuler dans la somme et faire coïncider les coefficients stœchiométriques par les multiplications:
2hcl (g) + 1/22(g) → H2Ou (l) + cl2(g) (ΔH = -202.4 kJ / mol) * (1/2)
Cette équation a été multipliée par 1/2 pour avoir 2HCl au lieu de 4HCl
H2(g) + f2(g) → 2HF (l) (ΔH = -600.0 kJ / mol) * (2)
Cette équation multipliée par 2 pour avoir f2 et no 1 / 2f2
H2Ou (l) → h2(g) + 1/2O2(g) (ΔH = -285.8 kJ / mol) * (-1)
Pendant ce temps, ce dernier s'est multiplié par -1 pour "le tourner". Ainsi, nous avons les équations ordonnées et prête à ajouter.
Somme des équations
Ajouter tout nous donne:
2hcl (g) + 1/22(g) → H2Ou (l) + cl2(g) (ΔH = -101.2 kJ / mol)
H2(g) + f2(g) → 2HF (l) ΔH = -1200.0 kJ / mol)
H2Ou (l) → h2(g) + 1/2O2(g) (ΔH = 285.8 kJ / mol)
2hcl (g) + f2(g) → 2hf (l) + cl2(g)
Notez que les termes 1/22, H2Ou et h2 Ils sont annulés parce qu'ils sont des deux côtés de la flèche. Des enthalpies sont également ajoutés, donnant:
ΔHrx = 285.8 kJ / mol + (-101.2 kJ / mol) + (-1200.0 kJ / mol)
Cette expression est la même que le début:
ΔH = ΔH1 + ΔH2 + ΔH3
Et donc, nous avons que ΔHrx est égal à:
ΔHrx = -1015.4 kJ / mol
- Exemple 2
Dans cet exemple, on verra que les enthalpies des réactions alternatives correspondent aux enthalpies de la formation de composés d'intérêt.
Il est souhaité déterminer ΔHrxn pour la prochaine réaction de décomposition:
2SO3(g) → 2SO2(g) + ou2(g)
Et les enthalpies de formation des composés SO sont comptés à portée de main3 Et ainsi2:
S (s) + o2(g) → Donc2(g) (ΔH = -296.8 kJ / mol)
Peut vous servir: isopréno: structure, propriétés, applicationsS (S) + 3 / 2O2(g) → Donc3(g) (ΔH = -395.6 kJ / mol)
Commande d'équations
Cet exercice sera résolu de la même manière que l'exemple précédent. Il devrait en être ainsi3 avoir raison, et multiplier par 2. Pour cela, nous devons "tourner" l'équation de la formation SO3 le multiplier par -1, puis en le multipliant par 2:
2SO3(g) → 2s (s) + 3o2(g) (ΔH = -395.6 kJ / mol) * (-2)
L'équation de la formation SO2 Nous le multiplions également par 2:
2s (s) + 2e2(g) → 2SO2(g) (ΔH = -296.8 kJ / mol) * (2)
Somme des équations
Maintenant, les équations sont ajoutées:
2SO3(g) → 2s (s) + 3o2(g) (ΔH = 791.2 kJ / mol)
2s (s) + 2e2(g) → 2SO2(g) (ΔH = -593.6 kJ / mol)
2SO3(g) → 2SO2(g) + ou2(g)
Notez que le terme 2S est éliminé car il est des deux côtés de la flèche. Aussi, 3ème2 2o est soustrait2 donner un o2. La somme des enthalpies, et par conséquent, la valeur de Δhrxn sera:
ΔH = ΔHrxn = 791.2 kJ / mol + (-593.6 kJ / mol)
= 197.6 kJ / mol
Comme toute réaction de décomposition, elle est endothermique, donc son enthalpie est positive.
Méthode alternative
Il existe une méthode pour atteindre ce même résultat de manière plus directe et simple. Cela a été mentionné dans une section précédente.
2SO3(g) → 2SO2(g) + ou2(g)
Pour déterminer le ΔHRXN de cette réaction, nous devons calculer ΔHºF (réactifs) et ΔHºF (produits). Le Δhºf (donc3) est égal à -395.6 kJ / mol, tandis que le ΔHºF (donc2) est égal à -296.8 kJ / mol. Le ΔHºf (ou2) est égal à 0, car l'oxygène élémentaire existe comme une molécule de o2 et pas comme des atomes ou gratuits.
Donc nous avons:
ΔHrxn = ΔHºf (produits) - ΔHºF (réactifs)
= [Δhºf (donc2) + ΔHºf (ou2)] - Δhºf (donc3)
= Δhºf (donc2) - ΔHºf (donc3)
Cependant, nous devons multiplier les deux enthalpies d'entraînement par 2, afin de correspondre aux coefficients stoechiométriques en ce qui concerne l'équation chimique:
Δhrxn = 2Δhºf (donc2) - 2Δhºf (donc3)
Et calculer nous avons:
Δhrxn = 2 (-296.8 kJ / mol) - 2 (-395.6 kJ / mol)
= 197.6 kJ / mol
En fait, c'est ainsi qu'il est généralement préféré pour résoudre tous les exercices dans lesquels la loi Hess est appliquée.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2020). La loi de Hess. Récupéré de: dans.Wikipédia.org
- Cohen Shelly. (18 mai 2020). La loi de Hess. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Clark Jim. (2010). Les calculs de la loi et de l'enthalpie de Hess. Récupéré de: Chemguide.co.ROYAUME-UNI
- Helmestine, Anne Marie, Ph.D. (11 février 2020). Définition de la loi de Hess. Récupéré de: Thoughtco.com
- Foir Laura. (2020). Loi de Hess: définition, formule et exemple. Étude. Récupéré de: étudier.com
- Quimitube. (2014). Théorie 14 Thermochimie: calcul de l'enthalpie d'une réaction de la loi de Hess. Récupéré de: Quimitube.com
- « Tension de tension comment elle se fait, propriétés, exemples
- Test de compression comment il est effectué, propriétés, exemples »

