Boyle Law
- 4714
- 444
- Prof Ines Gaillard
Quelle est la loi de Boyle?
La le droit de Boyle ou Boyle-Maleotte Law C'est celui qui exprime la relation entre la pression exercée par ou sur un gaz, et le volume que cela occupe; Garder constamment à la fois la température du gaz, ainsi que sa quantité (nombre de moles).
Cette loi, ainsi que celle de Charles, Gay-Lussac, Charles et Avogadro, décrit le comportement d'un gaz idéal; Plus précisément, dans un conteneur fermé sous réserve de changements de volume exercés par une force mécanique.
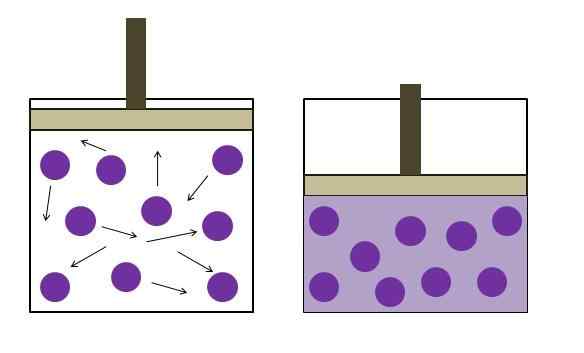
 Pression de réduction de la pression accrue. Source: Gabriel Bolívar
Pression de réduction de la pression accrue. Source: Gabriel Bolívar L'image supérieure résume brièvement la loi de Boyle. Les points violets représentent des molécules ou des atomes de gaz, qui entrent en collision avec les parois internes du conteneur (à gauche). En diminuant l'espace ou le volume disponible du conteneur occupé par ce gaz, les collisions sont augmentées, ce qui se traduit par une augmentation de la pression (à droite).
Cela montre que la pression P et le volume V du gaz est inversement proportionnelle si le récipient est étroitement fermé; Sinon, une plus grande pression serait égale à une plus grande dilatation du conteneur.
Si un graphique V contre P, avec les données de V et P sur les axes et et x, respectivement, serait observé, une courbe asymptotique serait observée. Plus le V inférieur, plus l'augmentation de P; C'est-à-dire que la courbe s'étendra vers des valeurs élevées de p sur l'axe x.
Bien sûr, la température reste constante; Mais, si la même expérience était réalisée à différentes températures, les positions relatives de ces courbes V VS P changeraient sur l'axe cartésien. Le changement serait encore plus évident s'il s'agissait de graphiques sur un axe à trois dimensions, avec une constante T sur l'axe z.
Histoire de la loi de Boyle
Antécédents
Depuis que le scientifique Galileo Galilei a exprimé sa croyance en l'existence du vide (1638), les scientifiques ont commencé à étudier les propriétés de l'air et des lacunes partielles.
Le chimiste angloilandique, Robert Boyle, a commencé son étude sur les propriétés aériennes en 1638 en apprenant qu'Otto von Guericke, ingénieur allemand et ingénieur physique, avait construit une bombe aérienne.
Peut vous servir: Bromine: historique, structure, configuration électronique, propriétés, utilisationsExpérience de mercure
Pour réaliser ses études sur la pression atmosphérique, Boyle a utilisé un tube de forme "J", dont la construction a été attribuée à Robert Hooke, un assistant de Boyle. L'extrémité du bras court a été scellée, tandis que l'extrémité du bras long du tube était ouverte pour placer le mercure.
Dès le début, Boyle voulait étudier l'élasticité de l'air, qualitativement et quantitativement. Lorsque Mercury a coulé à travers l'extrémité ouverte du tube sous la forme de "J", Boyle a déduit que l'air dans le bras court du tube a été contracté sous la pression de Mercure.
Résultats
Plus la quantité de mercure ajoutée au tube est grande, plus la pression exercée dans l'air est grande et plus son volume. Boyle a obtenu un graphique exponentiel négatif du volume d'air en fonction de la pression.
Pendant ce temps, si le volume de l'air contre la pression inverse est tracé, il y a une ligne droite de pente positive.
En 1662, Boyle a publié la première loi physique qui a été donnée sous la forme d'une équation, qui indique la dépendance fonctionnelle de deux variables. Dans ce cas, la pression et le volume.
Boyle a déclaré qu'il y avait une relation inverse entre la pression exercée sur un gaz et le volume occupait ce gaz, cette relation relativement vraie pour les gaz réels étant. La plupart des gaz se comportent comme des gaz idéaux pour modérer les pressions et les températures.
Lorsque des pressions plus élevées et des températures plus basses se produisent, les écarts par rapport au comportement des gaz réels des idéaux sont devenus plus notables.
Edme Mariotte
Le physicien français Edme Mariote (1620-1684) a découvert indépendamment la même loi en 1679. Mais il avait le mérite de montrer que le volume varie avec la température. C'est pourquoi cela s'appelle la loi ou la loi de Mariote de Boyle et Mariote.
Renforcement de la loi
Daniel Bernoulli (1737) a renforcé la loi de Boyle en soulignant que la pression d'un gaz est produite par les impacts des particules de gaz sur les parois du récipient qui le contiennent.
Il peut vous servir: nucléophile: attaque nucléophile, types, exemples, nucléophilicitéEn 1845, John Waterston a publié un article scientifique, qui se concentre sur les principaux principes de la théorie cinétique des gaz.
Par la suite, Rudolf Clausius, James Maxwell et Ludqwig Boltzmann ont consolidé la théorie cinétique des gaz, qui relie la pression exercée par un gaz avec la vitesse des particules de gaz en mouvement en mouvement en mouvement.
Plus le volume du récipient contenant un gaz est faible, plus la fréquence des impacts des particules qui le forment contre les parois du récipient; Et par conséquent, plus la pression exercée par le gaz est grande.
Quelle est cette loi?
Les expériences réalisées par Boyle soulignent qu'il existe une relation inverse entre le volume occupé par un gaz et la pression exercée dessus. Cependant, la relation susmentionnée n'est pas totalement linéaire, comme indiqué par un graphique de variation de volume en fonction de la pression attribuée à Boyle.
Dans la loi de Boyle, il est indiqué que le volume occupé par un gaz est inversement proportionnel à la pression. Il est également indiqué que le produit de la pression d'un gaz par son volume est constant.
Expression mathématique
Pour arriver à l'expression mathématique de la loi de Boyle, cela commence:
V ∝ 1 / p
Où il indique que le volume occupé par un gaz est inversement proportionnel à sa pression. Cependant, il y a une constante qui dicte à quel point cette relation est inversement proportionnelle.
V = k / p
Où k est la proportionnalité constante. Effacer K vous avez:
VP = k
Le produit de la pression d'un gaz par son volume est constant. Ensuite:
V1P1 = K et v2P2 = k
Et cela peut être déduit que:
V1P1 = V2P2
Ce dernier est l'expression ou l'équation finale de la loi de Boyle.
Pourquoi est-ce? Quels problèmes résolvent la loi de Boyle?
Machines à vapeur
La loi de Boyle-Maleotte est appliquée dans le fonctionnement des machines à vapeur. Il s'agit d'un moteur à combustion externe qui utilise la transformation de l'énergie thermique d'une quantité d'eau en énergie mécanique.
L'eau est chauffée dans une chaudière étroitement fermée, et la vapeur produite exerce une pression selon la loi de Boyle qui produit une expansion d'un volume de cylindre en poussant un piston.
Peut vous servir: facteur de dilutionLe mouvement linéaire du piston est transformé en un mouvement de rotation, en utilisant un système de manivelles et de manivelle, qui peut conduire les roues d'une locomotive ou le rotor d'un générateur électrique.
Boissons sirotantes
L'action de l'aspiration d'un soda ou d'un jus d'une bouteille à travers un tube en plastique est liée à la loi de Boyle. Lorsque l'air du tube est suggéré en utilisant la bouche, il y a une diminution de la pression à l'intérieur du tube.
Cette chute de pression facilite le mouvement ascendant du liquide dans le tube, permettant son ingestion. Ce même principe fonctionne dans l'extraction du sang en utilisant une seringue.
Système respiratoire
La loi de Boyle est étroitement liée au fonctionnement du système respiratoire. Pendant la phase d'inspiration, la contraction du diaphragme et d'autres muscles se produit; Par exemple, des intercostaux externes qui produisent une expansion de la cage thoracique.
Cela provoque une diminution de la pression intrapleurale, provoquant une expansion pulmonaire qui produit une augmentation du volume pulmonaire. Par conséquent, la pression intrapulmonaire diminue en fonction de ce qui est soulevé dans la loi de Boyle.
En devenant subatose la pression intrapulmonaire, l'air atmosphérique s'écoule dans les poumons, ce qui produit une augmentation de la pression des poumons; correspondant ainsi à sa pression à la pression atmosphérique et concluant la phase d'inspiration.
Par la suite, les muscles inspirants se détendent et les muscles expiratoires se contractent. De plus, une rétraction pulmonaire élastique est produite, un phénomène qui produit une diminution du volume pulmonaire, avec une augmentation conséquente de la pression intrapulmonaire, explicable par la loi de Boyle.
En augmentant la pression intrapulmonaire et en devenant supérieure à la pression atmosphérique, l'air s'écoule à l'intérieur des poumons jusqu'à l'atmosphère. Cela se produit jusqu'à ce que les pressions soient égales, ce qui conclut la phase d'expiration.
Les références
- La loi de Boyle. Encyclopædia Britannica. Récupéré de: Britannica.com
- La formule de la loi de Boyle. Récupéré de: Thoughtco.com
- « Comment résoudre les problèmes de vie
- Oligocène ce qui est, caractéristiques, subdivisions, géologie »

