Loi sur la bière-lambert
- 1817
- 87
- Paul Dumas
Qu'est-ce que la loi de bière-lame?
La Loi sur la bière-lambert (Boer-Bougner) est celui qui relie l'absorption du rayonnement électromagnétique d'une ou plusieurs espèces chimiques, avec sa concentration et la distance qui monte la lumière dans les interactions de particules-photons. Cette loi rassemble deux lois en une.
La loi de Bouguer (bien que la reconnaissance soit davantage tombée sur Heinrich Lambert), établit qu'un échantillon absorbera un rayonnement plus élevé lorsque les dimensions de l'environnement absorbant ou matériel sont plus grandes; Plus précisément, son épaisseur, qui est de la distance l Cela traverse la lumière en entrant et en sortant.
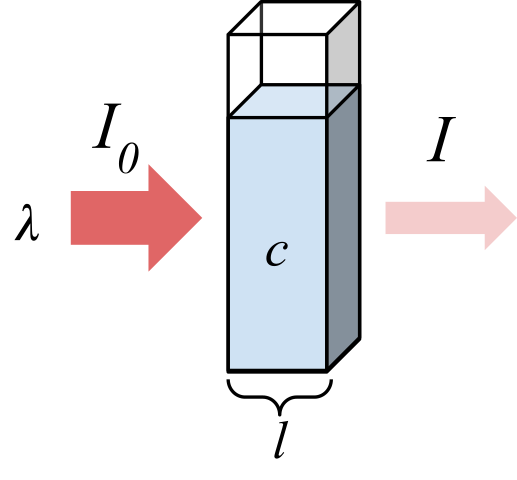 Rayonnement absorbé par un échantillon. Source: marmot2019 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons
Rayonnement absorbé par un échantillon. Source: marmot2019 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons L'image supérieure montre l'absorption du rayonnement monochromatique; c'est-à-dire composé d'une seule longueur d'onde, λ. Le milieu absorbant est à l'intérieur d'une cellule optique, dont l'épaisseur est l, et contient des espèces chimiques avec une concentration c.
Le faisceau lumineux a une intensité initiale et finale, désignée avec des symboles I0 Et moi, respectivement. Notez qu'après interagir avec le milieu absorbant, je suis moins que je0, ce qui montre qu'il y avait l'absorption des rayonnements. Plus ils sont âgés c et l, Je serai plus petit en ce qui concerne je0; c'est-à-dire qu'il y aura plus d'absorption et moins transmittance.
Explication de la loi de la bière-lambe
L'image supérieure englobe parfaitement cette loi. L'absorption du rayonnement dans un échantillon augmente ou diminue de façon exponentielle en fonction de c soit l. Pour laisser la loi complètement et facilement comprise, il est nécessaire de border ses aspects mathématiques.
Comme je viens de mentionner, je0 Et je suis les intensités du faisceau lumineux monochromatique avant et après la lumière, respectivement. Certains textes préfèrent utiliser les symboles P0 et p, qui font allusion à la radioprophilie et non à son intensité. Ici, l'explication continuera à utiliser les intensités.
Peut vous servir: acétophénonePour linéariser l'équation de cette loi, le logarithme doit être appliqué, généralement la base 10:
Journal (je0/ I) = εlc
Le terme (je0/ I) indique combien l'intensité du rayonnement du produit d'absorption diminue. La loi de Lambert ne considère que L (εl) uniquement, tandis que la bière ignore L, mais place c Au lieu de cela (εc). L'équation plus élevée est l'union des deux lois, et est donc l'expression mathématique générale de la loi sur la bière-lambe.
Absorbance et transmittance
L'absorbance est définie par le terme journal (i0/ Yo). Ainsi, l'équation est exprimée comme suit:
A = εlc
Où ε est le coefficient d'extinction ou d'absorption molaire, qui est une constante à une certaine longueur d'onde.
Notez que si l'épaisseur de l'absorbant reste constante, tout comme ε, l'absorbance à dépendre uniquement de la concentration c, d'espèces absorbantes. De plus, c'est une équation linéaire, y = mx, où et est un, et X est c.
À mesure que l'absorbance augmente, la transmittance diminue; C'est la quantité de rayonnement qui parvient à être transmise après l'absorption. Ils sont donc inverses. Oui0/ J'indique le degré d'absorption, I / I0 C'est égal à la transmittance. Sachant ceci:
I / I0 = T
(Yo0/ I) = 1 / t
Journal (je0/ I) = log (1 / t)
Mais, log (je0/ I) il est également égal à l'absorbance. Ainsi, la relation entre et t est:
A = log (1 / t)
Et en appliquant les propriétés des logarithmes et en sachant que Log1 est égal à 0:
A = -logt
Habituellement, les transmissions sont exprimées en pourcentages:
% T = i / i0∙ 100
Graphiques
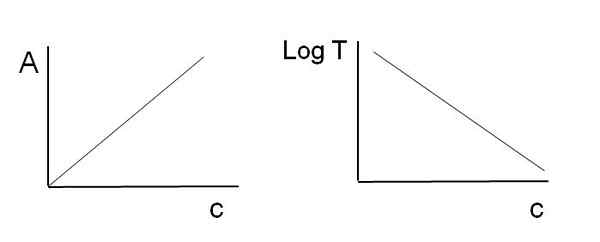
Comme indiqué ci-dessus, les équations correspondent à une fonction linéaire; Par conséquent, il est prévu que lorsque vous les graphiques, ils donneront une ligne.
Peut vous servir: qu'est-ce que la cinétique chimique? Graphiques utilisés pour la loi sur la bière-lambert. Source: Gabriel Bolívar
Graphiques utilisés pour la loi sur la bière-lambert. Source: Gabriel Bolívar Notez qu'à gauche de l'image ci-dessus, vous avez la ligne obtenue lors de la graphique contre c, et à droite la ligne correspondant au graphique LOGT contre c. L'un a une pente positive et l'autre négatif; Plus l'absorbance est grande, plus la transmittance est faible.
Grâce à cette linéarité, la concentration des espèces chimiques absorbantes (chromophores) peut être déterminée si l'on sait combien de rayonnement ils absorbent (a), ou quelle quantité de rayonnement il est transmis (logt). Lorsque cette linéarité n'est pas observée, il est dit qu'il fait face à une déviation, positive ou négative, de la loi de Beer-Lambert.
Applications de droit de la bière-lambbe
En termes généraux, certaines des applications les plus importantes de cette loi sont mentionnées ci-dessous:
-Si une espèce chimique a de la couleur, c'est un candidat exemplaire à analyser par des techniques colorimétriques. Ceux-ci sont basés sur la loi sur la bière-Lambert et permet de déterminer la concentration des analytes sur la base des absorbances obtenues avec un spectrophotomètre.
-Il permet de construire les courbes d'étalonnage, avec lesquelles en tenant compte de l'effet de matrice de l'échantillon, la concentration des espèces d'intérêt est déterminée.
-Il est largement utilisé pour analyser les protéines, car plusieurs acides aminés ont des absorptions importantes dans la région ultraviolette du spectre électromagnétique.
-Les réactions chimiques ou les phénomènes moléculaires qui impliquent un changement de coloration, peuvent être analysés par des valeurs d'absorbance, à une ou plusieurs longueurs d'onde.
-En réalisant une analyse multivariée, des mélanges de chromophores complexes peuvent être analysés. De cette façon, la concentration de tous les analytes peut être déterminée, et également classer les mélanges et les différencier les uns des autres; Par exemple, exclure si deux minéraux identiques proviennent du même continent ou pays spécifique.
Peut vous servir: acide fortExercices résolus
Exercice 1
Quelle est l'absorbance d'une solution qui présente une transmittance de 30% à une longueur d'onde de 640 nm?
Pour le résoudre, allez simplement aux définitions de l'absorbance et de la transmittance.
% T = 30
T = (30/100) = 0,3
Et sachant que a = -logt, le calcul est direct:
A = -log 0,3 = 0,5228
Notez que vous manquez d'unités.
Exercice 2
Si la dissolution de l'année précédente se compose d'une espèce avec la concentration est de 2,30 ∙ 10-4 M, et en supposant que la cellule a une épaisseur de 2 cm: quelle devrait être sa concentration pour obtenir une transmittance de 8%?
Il pourrait être résolu directement avec cette équation:
-Logt = εlc
Mais, la valeur de ε est inconnue. Par conséquent, il doit être calculé avec les données précédentes, et il est supposé qu'il reste constant dans un large éventail de concentrations:
ε = -logt / lc
= (-Log 0,3) / (2 cm x 2,3 ∙ 10-4 M)
= 1136,52 m-1∙ cm-1
Et maintenant, vous pouvez procéder à calculer avec% t = 8:
C = -Logt / εl
= (-Log 0,08) / (1136,52 m-1∙ cm-1 x 2cm)
= 4,82 ∙ 10-4 M
Ensuite, il suffit que les espèces W doublent sa concentration (4,82 / 2,3) pour diminuer son pourcentage de transmittance de 30% à 8%.
Les références
- La loi sur la bière-lambert. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- La loi sur la bière-lambert. Récupéré de: Chemguide.co.ROYAUME-UNI
- « Darwinisme social qu'est-ce que les caractéristiques, les auteurs, les conséquences
- Conséquences des tempêtes et des ouragans dans l'écosystème »

