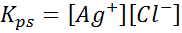Droit de l'action de masse

- 1855
- 482
- Raphaël Meyer
 Une réaction de précipitations implique l'équilibre de la solubilité, qui est régie par la loi sur l'action de masse
Une réaction de précipitations implique l'équilibre de la solubilité, qui est régie par la loi sur l'action de masse Quelle est la loi sur l'action de masse?
La Droit de l'action de masse indique que la vitesse d'une réaction dépend de la concentration de ses réactifs soulevés à ses coefficients stoechiométriques. Cette loi permet de relier entre elles les concentrations dans l'équilibre des réactifs et des produits d'une réaction chimique réversible. En d'autres termes, il établit la formule de la constante d'équilibre.
La loi sur l'action de masse a été énoncée par les chimistes norvégiens (et crème) Cato M. Guldberg (1836-1902) et Peter Waage (1833-1900) en 1864. C'est l'une des lois fondamentales de la chimie, car elle nous permet de calculer les concentrations finales en équilibre des montants initiaux.
En plus de cela, la loi de masse nous permet également de comprendre facilement les effets des changements dans les concentrations de l'une des espèces en équilibre. En d'autres termes, cela nous permet de comprendre comment fonctionnent les principes de Le Chatlier.
En dépit d'être appelée la «loi sur l'action de masse», il ne fait pas vraiment référence aux masses des réactifs et des produits, mais plutôt à leurs concentrations. La raison qui s'appelle le droit de l'action de masse et non la loi d'action des concentrations est que la concentration était appelée "masse active".
La loi d'action de masse et la constante d'équilibre
Selon la loi sur l'action de masse, lorsque les réactions réversibles atteignent l'équilibre, ce n'est pas parce que la réaction s'arrête. Au contraire, l'équilibre est atteint lorsque la vitesse de la réaction directe est effectuée égale à la vitesse de la réaction inverse. Lorsque cela se produit, toutes les espèces chimiques se produisent et consommées à la même vitesse, donc leurs concentrations deviennent constantes (elles cessent de changer).
Peut vous servir: toluène: structure, propriétés, utilisations, obtentionGuldberg et Waage ont découvert que les vitesses des deux réactions (directe et inverse) dépendent de la concentration molaire (en mol / L) de leurs réactifs élevés aux coefficients stoechiométriques. À partir de ces observations, ils ont réussi à trouver la formule pour la constante d'équilibre.
Selon cette loi, pour toute réaction chimique réversible qui atteint l'équilibre,
«… La relation entre le produit des concentrations molaires des produits relevés à leurs coefficients stoechiométriques et le produit des concentrations molaires des réactifs élevés à leurs coefficients stoechiométriques est constant à une certaine température."
Cette constante est appelée "constante d'équilibre" et est représentée avec le symbole kc.
La formule constante d'équilibre
Voyons à quoi ressemble la déclaration précédente sous la forme d'une équation mathématique. Il s'agit d'une réaction chimique réversible comme celle présentée ci-dessous, où A et B sont les réactifs, C et D les produits, et A, B, C et D sont les coefficients stoechiométriques respectifs de la réaction équilibrée:
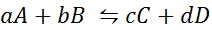
Pour une réaction générique comme celle-ci, la constante d'équilibre est donnée par:
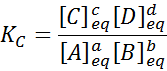
où [a], [b], [c] et [d] sont les concentrations molaires de a, b, c et d en équilibre.
La constante d'équilibre en pressions
La formule précédente pour la constante d'équilibre s'applique à toute réaction chimique dans laquelle toutes les substances sont dans la même phase (c'est-à-dire qu'elles sont toutes en phase aqueuse, ou en phase gazeuse, par exemple). Cependant, dans le cas des réactions en phase gazeuse, il est plus pratique de travailler avec des pressions qu'avec des concentrations.
Comme la concentration molaire des gaz est proportionnelle à leur pression partielle, la formule de la constante d'équilibre peut être réécrite en termes de pressions, comme suit:
Il peut vous servir: 30 utilisations des acides carboxyliques dans la vie quotidienne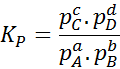
Où pPOUR, pB, pC Et PD Ce sont respectivement les pressions partielles de A, B, C et D. Dans ce cas, kP Il est appelé l'équilibre constant des pressions et est lié à kC À travers la formule suivante:
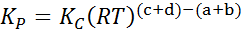
où r est la constante universelle des gaz idéaux et t est la température absolue à Kelvin.
Réactions impliquant plus d'une phase
Parfois, une réaction chimique implique la formation d'un solide comme précipité d'une solution, ou la formation d'un liquide à partir de réactifs qui réagissent en phase gazeuse. Dans ces cas, la réaction ne se produit pas dans la même phase, nous devons donc modifier la formule constante d'équilibre.
Heureusement, les modifications sont très simples. La seule chose que nous devons prendre en compte lors de l'écriture de la formule de la constante d'équilibre est que les substances pures qui apparaissent sous forme de solides ou de liquides ne devraient pas les prendre en compte. Si nécessaire, nous plaçons plutôt un 1.
En conclusion, la loi d'action de masse permet d'écrire la formule de la constante d'équilibre à la fois en concentrations et en pressions partielles. En connaissant l'un des deux, l'autre peut être trouvé à partir du premier.
Enfin, nous devons être prudents et examiner la phase dans laquelle se trouvent toutes les espèces chimiques, pour savoir si nous devons les inclure ou non dans la constante d'équilibre.
Exemples de l'utilisation de la loi sur l'action de masse
Dans les exemples suivants, nous montrons comment utiliser la loi sur l'action de masse pour écrire les formules de constantes d'équilibre pour différents types de réactions chimiques.
Réactions des réactions à l'état gazeux
Exemple 1: la décomposition de n2SOIT4 en phase gazeuse
Alors2SOIT4 C'est un gaz brun qui se décompose selon la réaction suivante:
Il peut vous servir: acide láurique: structure, propriétés, utilisations, avantages, effets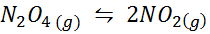
 Échantillon NO2 à différentes températures montrant le déplacement de l'équilibre au N2O4 brun
Échantillon NO2 à différentes températures montrant le déplacement de l'équilibre au N2O4 brun Pour cette réaction, les constantes d'équilibre des concentrations et des pressions sont données par:
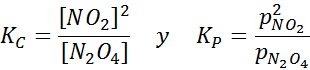
Exemple 2: L'oxydation du monoxyde de carbone
Le monoxyde de carbone est un gaz très toxique qui peut devenir du dioxyde de carbone lorsqu'il réagit avec l'oxygène selon la réaction suivante:
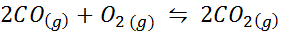
Pour cette réaction, les constantes d'équilibre des concentrations et des pressions sont données par:
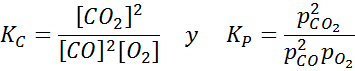
Soldes acides en phase aqueuse
Exemple 3: auto-longueur de l'eau
L'équilibre ionique de l'eau, également connu sous le nom de réaction d'auto-longueur de l'eau, est une réaction réversible entre deux molécules d'eau à l'état liquide. La réaction est:
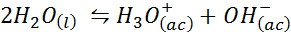
Lors de l'écriture de la constante d'équilibre pour cette réaction, nous devons tenir compte du fait que, dans ce cas, le seul réactif est un liquide pur dont la concentration est pratiquement constante. Pour cette raison, il n'est pas inclus dans la formule de la constante d'équilibre:
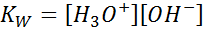
Il s'agit d'une constante d'équilibre très importante qui reçoit son propre nom (constante du produit ionique de l'eau) et son propre symbole (kW. W fait référence à l'eau en anglais, ce qui est dit toilettes). Cependant, c'est une constante d'équilibre dans les concentrations comme tout autre.
Soldes de solubilité
Exemple 4: équilibre de solubilité en chlorure d'argent
Lorsque nous préparons une solution saturée, un équilibre de solubilité est établi. Dans ce cas, l'équilibre est celui de la dissolution du chlorure d'argent, dont la réaction est donnée par:
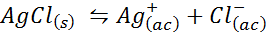
La constante d'équilibre de cette réaction (et de toutes les réactions de solution) n'inclut pas le chlorure d'argent (AGCL) car il est solide. De plus, comme dans le cas de l'eau, ces constantes reçoivent également un nom spécial «constant du produit de solubilité», représenté comme k$: