Structure et fonctions de la lactoferrine
- 3579
- 582
- Prof Ines Gaillard
La Lactoferrine, Également connue sous le nom d'apolactoferrine ou de lactotransferrine, c'est une glycoprotéine produite par de nombreuses espèces de mammifères qui ont la capacité de rejoindre et de transférer des ions fer (Fe3 +). Il est dans une grande partie des fluides corporels et est lié à la protéine plasmatique de la liaison au fer appelée "transferrine".
Il a été isolé en 1939 par Sorensen et Sorensen de Bovin Milk et, près de 30 ans plus tard, en 1960, Johannon a déterminé sa présence dans le lait maternel (son nom dérive de sa classification comme la protéine d'union de fer la plus abondante du lait de fer le plus abondant).
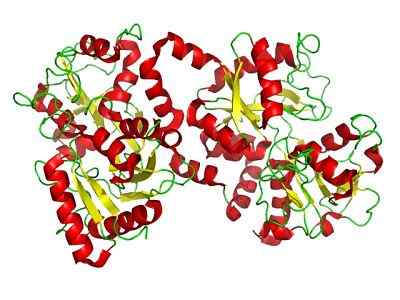
 Structure de lactoferrine (source: Liejealso [domaine public] via Wikimedia Commons)
Structure de lactoferrine (source: Liejealso [domaine public] via Wikimedia Commons) Les enquêtes ultérieures ont identifié la lactoferrine dans d'autres sécrétions de glandes exocrines telles que la bile, le jus pancréatique et les sécrétions de l'intestin grêle, ainsi que dans les granules secondaires des neutrophiles, des plasmocytes appartenant au système immunitaire.
Cette protéine se trouve également dans les larmes, la salive, le sperme, les liquides vaginaux, les sécrétions bronchiques et nasales et l'urine, bien qu'elle soit particulièrement abondante dans le lait (c'est la deuxième protéine en plus concentration après la caséine) et le calcul.
Bien qu'il ait été initialement considéré comme simplement comme une protéine avec une activité bactériostatique du lait, il s'agit d'une protéine avec une grande variété de fonctions biologiques, bien que toutes n'aient pas à voir avec leur capacité de transfert des ions fer.
[TOC]
Structure de lactoferrine
Lactoferrin, comme mentionné. C'est une protéine de base, chargée positivement et avec un point isoélectrique entre 8 et 8.5.
Lobe n et lobe c
Il est formé par une seule chaîne polypeptidique qui est pliée pour former deux lobes symétriques appelés lobe N (1-332 déchets) et lobe C (344-703 déchets qui partagent entre 33 et 41% d'homologie entre eux-mêmes.
Peut vous servir: lipoprotéinesLe lobe N et le lobe C sont formés par des feuilles pliées β et des hélices alpha, qui constituent deux domaines par lobe, domaine I et domaine II (C1, C2, N1 et N2).
Les deux lobes sont connectés à travers une région de «charnière» composée d'une hélice alpha entre les déchets 333 et 343, ce qui offre une plus grande flexibilité moléculaire à la protéine.
L'analyse de la séquence d'acides aminés de cette protéine révèle un grand nombre de sites potentiels pour la glycosylation. Le degré de glycosylation est très variable et détermine la résistance à l'activité des protéases ou un pH considérablement faible. Le saccharide le plus courant dans sa partie glucidique est la main, avec plus ou moins 3% de sucres hexotes et 1% d'hexosamines.
Chaque lobulus de la lactoferrine est capable de se lier réversible à deux ions métalliques, qu'il s'agisse de fer (Fe2 +, Fe3 +), de cuivre (Cu2 +), de zinc (Zn2 +), de cobalt (CO3 +) ou de manganèse (Mn2 +), en synergie avec un ion bicarbonate.
Autres molécules
Il peut également rejoindre, bien qu'avec moins d'affinité, d'autres molécules telles que les lipopolysaccharides, les glycosaminoglycanes, l'ADN et l'héparine.
Lorsque la protéine est liée à deux ions de fer est connue sous le nom de Hollactoferrine, alors que lorsqu'elle est sous sa forme "libre", elle est appelée apolctoferrine et lorsqu'elle est liée unique.
Apolactoferrine a une conformation ouverte, en attendant l'hololactoferrine a une configuration fermée, il est donc plus résistant à la protéolyse.
Autres formes de lactoferrine
Certains auteurs décrivent l'existence de trois isoformes de lactoferrine: α, β et γ. La forme de lactoferrine-α est indiquée comme celle avec la capacité d'union au fer et sans activité de ribonucléase. Les formes de lactoferrine-β et de lactoferrine -γ ont une activité de ribonucléase, mais elles ne sont pas en mesure de rejoindre des ions métalliques.
Les fonctions
La lactoferrine est une glycoprotéine avec une affinité pour l'union de fer bien supérieure à celle de la transferrine, une protéine de convoyeur en fer dans le plasma sanguin, ce qui lui donne la capacité de rejoindre les ions de ce métal dans un large éventail de pH.
Peut vous servir: isolement géographiqueCompte tenu du fait qu'il a une charge nette positive et est distribué dans divers tissus, il s'agit d'une protéine multifonctionnelle impliquée dans diverses fonctions physiologiques telles que:
- La régulation de l'absorption du fer intestinal
- Processus de réponse immunitaire
- Mécanismes antioxydants corporels
- Il agit comme un agent anticogène et anti-inflammatoire
- Il est un agent protecteur contre les infections microbiennes
- Fonctionne comme un facteur de transcription
- Est impliqué dans l'inhibition de la protéase
- C'est une protéine antivirale, antifongique et antiparasite
- Il fonctionne également comme procoagulant et a une activité de ribonucléase
- C'est un facteur de croissance osseux.
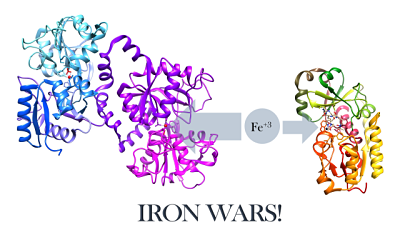 Représentation structurelle de la lactoferrine et un sidérophore de e. Coli (source: w.Henley [CC By-Sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Représentation structurelle de la lactoferrine et un sidérophore de e. Coli (source: w.Henley [CC By-Sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) En ce qui concerne le combat des infections microbiennes, la lactoferrine agit de deux manières:
- L'enlèvement de fer dans les sites d'infection (qui provoque un manque nutritionnel dans les micro-organismes infectieux, agissant comme bactériostatique) ou
- Interagir directement avec l'agent infectieux, ce qui peut provoquer une lyse cellulaire.
Utilisations pharmacologiques
La lactoferrine peut être obtenue directement lorsqu'elle est purifiée à partir du lait de vache, mais d'autres systèmes modernes sont basés sur sa production en tant que protéine recombinante dans différents organismes de croissance facile, rapide et économique.
En tant que composé actif de certains médicaments, cette protéine est utilisée pour le traitement de l'estomac et des ulcères intestinaux, ainsi que la diarrhée et l'hépatite C.
Il est utilisé contre les infections d'origine bactérienne et virale et, en outre, il est utilisé comme système immunitaire stimulant pour la prévention de certaines pathologies telles que le cancer.
Sources de lactoferrine dans le corps humain
L'expression de cette protéine peut être initialement détectée dans les étapes de deux et quatre cellules de développement embryonnaire puis au stade blastocyste, jusqu'au moment de la mise en œuvre.
Peut vous servir: microévolutionIl est par la suite mis en évidence dans les neutrophiles et les cellules épithéliales des systèmes digestifs et reproductifs en formation.
La synthèse de cette protéine est réalisée dans des épithéliums myéloïdes et sécrétoires. Chez un être humain adulte, les niveaux les plus élevés d'expression de lactoferrine sont détectés dans le lait maternel et le calcul.
Il peut également être trouvé dans de nombreuses sécrétions de muqueuses telles que les liquides utérins, séminaux et vaginaux, dans la salive, la bile, le jus pancréatique, les sécrétions de l'intestin mince, les narines et les larmes. Il a été déterminé que les niveaux de cette protéine changent pendant la grossesse et pendant le cycle menstruel des femmes.
En 2000, la production de lactoferrine dans les reins a été déterminée, où elle est exprimée et sécrétée à travers les tubules de collecte et peut être réabsorbée dans la partie distale d'entre eux.
La plupart des lactoferrine plasmatiques chez l'homme adulte proviennent de neutrophiles, où il est stocké dans des granules secondaires spécifiques et des granules tertiaires (bien qu'en moindre concentration).
Les références
- Adlerva, L., Bartoskova, un., & Faldyna, m. (2008). Lactoferrin: une revue. Veterinarni Medicine, 53 (9), 457-468.
- Berlutti, f., Pantanella, f., Natalizi, t., Frioni, un., Paesano, R., Polimeni, un., & Valenti, P. (2011). Propriétés antivirales de la lactoferrine-une molécule d'immunité naturelle. Molécules, 16 (8), 6992-7018.
- Brock, J. (Année mille neuf cents quatre-vingts-quinze). Lactoferrine: une protéine immunorégulatrice multifonctionnelle? Immunology Today, 16 (9), 417-419.
- Brock, J. H. (2002). La physiologie de la lactoferrine. Biochimie et biologie cellulaire, 80 (1), 1-6.
- González-Chávez, S. POUR., Arévalo-Gallegos, S., & Rascón-cruz, q. (2009). Lactoferrine: structure, fonction et applications. Journal international des agents antimicrobiens, 33 (4), 301-E1.
- Alicay, P. F., & Viljoen, m. (Année mille neuf cents quatre-vingts-quinze). Lactoferrin: une revue générale. Haematologica, 80 (3), 252-267.
- Naot, D., Gris, un., Reid, je. R., & Cornish, J. (2005). Lactoferrine-un nouveau facteur de croissance osseux. Médecine clinique et recherche, 3 (2), 93-101.
- Sanchez, L., Calvo, m., & Brock, J. H. (1992). Rôle biologique de la lactoferrine. Archives de la maladie dans l'enfance, 67 (5), 657.
- « Caractéristiques de réplication virale, cycle de réplication virale, exemple (VIH)
- Structure du bromure d'éthidium, propriétés, utilisations, toxicité »

