Concept d'isothermes d'adsorption, types, exemples

- 2270
- 705
- Raphaël Charles
Le Isothermes d'adsorption Ce sont des représentations graphiques du comportement d'une particule adsorbée, à la surface d'un solide ou d'un liquide, lorsque sa concentration augmente. Si les particules adsorbées correspondent à celles d'un gaz, alors sa pression est prise en compte.
En observant cette isotherme, une idée de la façon dont le processus d'adsorption a lieu peut être prise; Et donc, comment sont les interactions de particules-surface et les caractéristiques de surface. L'analyse de l'isotherme est déduite si la surface est lisse, poreuse ou microporeuse, ainsi que des condensations possibles.
 Composants nécessaires au graphique ou à la construction d'isothermes d'adsorption. Source: Gabriel Bolívar.
Composants nécessaires au graphique ou à la construction d'isothermes d'adsorption. Source: Gabriel Bolívar. L'image supérieure aide à clarifier le. Les particules adsorbées (cercles violets) sont les adsorbats si appelés. Tandis que l'adsorbant est celui qui a une zone sur laquelle les adsorbats seront adsorbés. À mesure que votre pression ou votre concentration augmente, plus le volume adsorbé sur l'adsorbant est grand.
Cette représentation simple correspond à une adsorption décrite par l'isotherme de type I. En utilisant des isothermes, des adsorption de gaz ou des infinités liquides sur des gels, des solides ou des catalyseurs sont étudiés.
[TOC]
Types d'isothermes d'adsorption
 Isothermes d'adsorption pour les systèmes au gaz solide. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Isothermes d'adsorption pour les systèmes au gaz solide. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) Cinq des principales isothermes expérimentaux utilisés par S sont indiqués ci-dessus. Brunauer pour classer les particules gazeuses sur les solides. Chacun décrit un processus d'adsorption différent. De plus, chacun a des modèles mathématiques qui cherchent à déduire le comportement de ses courbes.
Indisté de quelles sont les unités ou les variables utilisées dans les axes x (p / po) et y (x), l'axe x indique la pression ou la conversion de l'adsorbat «agit» sur le solide; Tandis que l'axe y, dit quelle part de cet adsorbat a été vraiment adsorbée à la surface dudit solide ou adsorbant.
Il peut vous servir: sulfate de cuivre (CUSO4): structure, propriétés, obtention, utilisationsAinsi, alors que nous nous déplaçons à droite de l'axe x, nous voyons comment la quantité de particules adsorbées augmente en fonction de l'augmentation de leurs pressions ou concentrations. Cela conduit à un maximum, à une désintégration, à une vallée, etc., que d'une manière ou d'une autre permettent d'interpréter comment l'adsorption a lieu.
Isotherme de type I
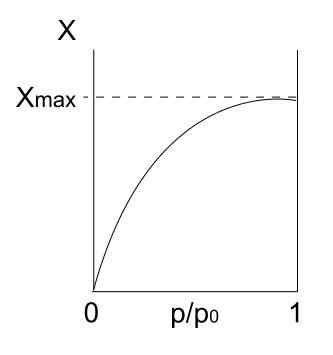 Isotherme de type I. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Isotherme de type I. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) Nous avons l'isotherme de type I ci-dessus, également connu sous le nom de Langmuir Isotherm, car son modèle a prédit la forme de cette courbe. Le voyant, il est immédiatement interprété qu'il y a une quantité maximale (xmax) de particules adsorbées, qui ne varieront pas, peu importe combien les pressions augmentent.
Cette valeur d'adsorption maximale peut être due à plusieurs raisons. L'un d'eux est qu'une chimisorction se produit, ce qui signifie que les particules ou les adsorbats sont fortement liés à la surface du solide ou de l'adsorbant. Une fois qu'il n'y a plus d'espace à la surface pour accueillir plus de particules, il n'y aura plus d'adsorption.
On dit alors qu'une monocouche s'est formée (comme les cercles violets de la première image).
Une autre raison de justifier l'isotherme de type I est qu'une fisorption se produit, ce qui signifie que les interactions de particules-surface sont très faibles (elles n'impliquent pas la formation de liaisons chimiques).
Dans ce cas, les particules finissent par entrer dans les micropores, qui une fois remplies, la surface n'aura pas plus d'endroits pour l'adsorction suivante; Autrement dit, il a peu de zone externe disponible (comme s'il s'agissait d'un très fin)). Ce comportement est observé lorsque des poudres microporeuses sont analysées.
Peut vous servir: silicium: historique, propriétés, structure, obtention, utilisationsType isotherme Ii
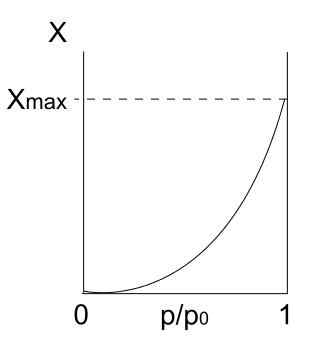
 Isotherme de type II. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Isotherme de type II. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) Nous avons l'isotherme de type II, également connu sous le nom d'isotherme sigmoïde. Ceci décrit les processus physiques pour les solides non poreux et les solides macroporeux.
Notez qu'au début, il ressemble à l'isotherme précédent, ce qui signifie que les particules adsorbées forment une monocouche sur la surface adsorbante. Une fois la monocouche prête, les autres particules seront adsorbées au-dessus de la première, donnant naissance à des multicouches. C'est à ce moment que nous voyons l'augmentation caractéristique de cette isotherme (à droite).
Une autre raison pour laquelle l'isotherme de type II est obtenu est que les particules ressentent une plus grande affinité pour la surface qu'elles. C'est-à-dire que la monocouche (particules-superficie) sera plus stable et durable que les multicouches (particules-particules) plus tard.
Type isotherme III
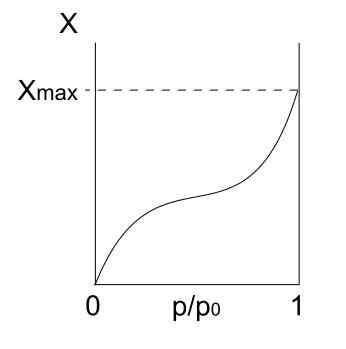
 Isotherme de type III. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Isotherme de type III. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) L'isotherme de type III est similaire au type II en ce qui concerne son interprétation: multicapas et physique. Cependant, cette fois, les interactions entre multicapas sont plus fortes que celles de la monocouche avec la surface du solide. Par conséquent, c'est une adsorption irrégulière, avec des monticules de particules adsorbées et de parties de surface libres.
Type isotherme Iv
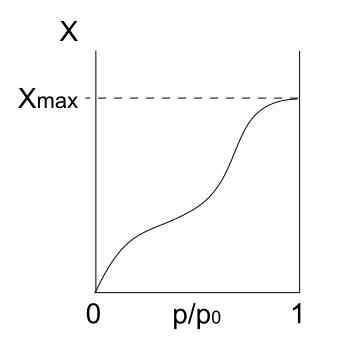 Isotherme de type IV. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Isotherme de type IV. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) L'isotherme de type IV décrit également les processus de fisisorption et multicouches, ressemblant à l'isotherme de type II; Mais maintenant, dans des solides poreux (et mésoporeux), où la condensation des particules gazeuses est possible en petits volumes liquides. Jusqu'à ce que le pore avec liquide soit "couvert", la monocouche ne sera pas complète.
Peut vous servir: chimie alimentaire: domaine d'étude, éléments, applicationsType isotherme V
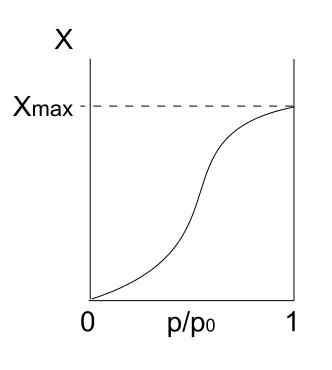 Isotherme de type V. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Isotherme de type V. Source: Daniele Pugliesi / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) L'isotherme de type V est similaire au type IV, mais cette fois, les formations des multicapas sont plus sujettes que le mono FORPA respectif. C'est-à-dire qu'il ressemble à l'adsorption décrite par l'isotherme de type III. Ici, multicapa atteint une épaisseur maximale, où il n'y a pas d'endroits pour plus de particules pour adsorber.
Exemples
Quelques exemples de systèmes solides au gaz seront mentionnés ci-dessous à côté du type d'isothermes qui ont été obtenus dans leurs études expérimentales:
-Ammoniac-Carbon (Type I)
-Azote-zéolites (type I)
-Hydrogène-carbone à des températures élevées (type I)
-Coal Oxygen-négro (Type I)
-Azote de silice (type II)
-Azote-hiérrophile (type II)
-Silice bromo-gel (type III)
-Vapeur d'iode de silice (type III)
-Azote-politique (type III)
-Kripton-négro du charbon (type IV)
-Benzène-gel d'oxyde ferrique (type IV)
-Vapeur à eau-carbone (type V)
Notez que les solides mentionnés étaient du charbon, du charbon noir, du fer métallique, de l'oxyde de fer, des zéolites et du gel de silice. Tous sont de bons exemples d'adsorbants avec diverses applications industrielles.
Les références
- Walter J. Moore. (1963). Chimie physique. Dans la thermodynamique et l'équilibre chimique. (Quatrième Ed.). Longmans.
- L'Iran. Levine. (2009). Principes de la physicochimie. Sixième édition, page 479-540. Mc Graw Hill.
- Glasstone. (1970). Manuel de chimie physique. Deuxième édition. D. Van Nostrand, Company, Inc.
- Unité 3. Phénomènes de surface. (s.F.). Adsorption. [PDF]. Récupéré de: DEPA.Finesse.Unam.mx
- Lowell S., Shields J.ET. (1984) Isothermes d'adsorption. Dans: surface de poudre et porosité. Springer, Dordrecht.
- Elsevier B.V. (2020). Isotherme d'adsorption. ScienceDirect. Récupéré de: ScienceDirect.com
- Wikipédia. (2020). Adsorption. Récupéré de: dans.Wikipédia.org
- « Départements de la région du Pacifique en Colombie
- À quoi sert le télescope? Les 3 utilisations principales »

