Interactions hydrophobes Qu'est-ce que, importance, exemples
- 2722
- 554
- Louna Baron
Le Interactions hydrophobes (HI) Ce sont les forces qui maintiennent la cohésion entre les composés apolaires immergés dans une solution polaire ou un solvant. Contrairement à d'autres interactions non covalentes, telles que les ponts d'hydrogène, les interactions ioniques ou les forces de van der Waals, les interactions hydrophobes ne dépendent pas des propriétés intrinsèques des solutés, mais plutôt des solvants.
Un exemple très illustratif de ces interactions peut être la séparation de phases qui se produit lorsqu'il s'agit de mélanger l'eau avec l'huile. Dans ce cas, les molécules d'huile "interagissent" les unes avec les autres en raison de l'ordre des molécules d'eau qui les entourent.
 Émulsion de la graisse dans l'eau (Catrin sohrabi [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons)
Émulsion de la graisse dans l'eau (Catrin sohrabi [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons) La notion de ces interactions existe depuis avant les années quarante. Cependant, le terme "lien hydrophobe" a été inventé par Kauzmann en 1959, tout en étudiant les facteurs les plus importants de la stabilisation de la structure à trois dimensions de certaines protéines.
Ce sont les interactions non spécifiques les plus importantes qui se déroulent dans les systèmes biologiques. Ils ont également un rôle important dans une variété d'applications d'ingénierie et l'industrie chimique et pharmaceutique que nous connaissons aujourd'hui.
Cause des interactions hydrophobes
La cause physique de lui est basée sur l'incapacité des substances apolaires de la formation de liaisons hydrogène avec des molécules d'eau dans une solution.
Ils sont connus comme des «interactions non spécifiques» car elles ne sont pas liées à l'affinité entre les molécules de soluté, mais plutôt avec la tendance des molécules d'eau à maintenir leurs propres interactions au moyen de liaisons hydrogène.
Peut vous servir: biosurfactantsAu contact de l'eau, des molécules apolaires ou hydrophobes ont tendance à ajouter spontanément, pour atteindre une plus grande stabilité en réduisant la zone de surface de contact avec l'eau.
Cet effet pourrait être confondu avec une forte attraction, mais ce n'est rien de plus qu'une conséquence du caractère apolaire des substances par rapport au solvant.
Expliqués d'un point de vue thermodynamique, ces associations spontanées se produisent à la recherche d'un état énergétiquement favorable, où vous avez la variation d'énergie la moins libre (∆g).
Compte tenu de ce ∆g = ∆H - T∆S, L'état le plus énergiquement favorable sera celui où l'entropie (∆S) Être plus grand, c'est-à-dire où il y a moins de molécules d'eau dont la liberté rotationnelle et translationnelle est réduite par le contact avec un soluté apolaire.
Lorsque des molécules apolaires sont associées les unes aux autres, forcées par des molécules d'eau, un état plus favorable est obtenu que si ces molécules restaient séparées, chacune entourée d'une «cage» de différentes molécules d'eau.
Importance biologique
Il a une grande pertinence, car ils se produisent dans la diversité des processus biochimiques.
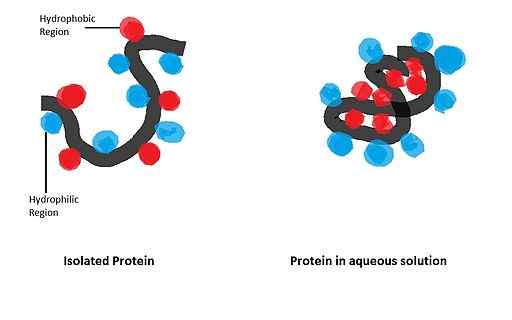
Parmi ces processus figurent les changements conformationnels des protéines, l'union des substrats enzymatiques, l'association des sous-unités des complexes enzymatiques, l'agrégation et la formation de membranes biologiques, la stabilisation des protéines dans les solutions aqueuses et autres.
En termes quantitatifs, différents auteurs ont donné la tâche de déterminer quelle est l'importance de la sienne dans la stabilité de la structure de grandes quantités de protéines, concluant que ces interactions contribuent à plus de 50%.
Il peut vous servir: glucose oxydase: caractéristiques, structure, fonctionsDe nombreuses protéines membranaires (intégrales et périphériques) sont associées à des bicouches lipidiques grâce à HI lorsque, dans leurs structures, ces protéines ont des domaines hydrophobes. De plus, la stabilité de la structure tertiaire de nombreuses protéines solubles dépend de HI.
Certaines techniques dans l'étude de la biologie cellulaire exploitent la propriété que certains détergents ioniques pos.
Les micels sont également utilisés dans des études pharmaceutiques qui impliquent la livraison de médicaments solubles en graisse et leur formation est également essentielle pour l'absorption de vitamines et de lipides complexes dans le corps humain.
Exemples d'interactions hydrophobes
Membranes
Un excellent exemple de HI est la formation de membranes cellulaires. Ces structures sont composées d'une bicouche de phospholipides. Votre organisation est donnée grâce à la sien qui se produit entre les queues apolaires dans la "répulsion" de l'environnement aqueux environnant.
Protéines
Il a une grande influence sur le repliement des protéines globulaires, dont la forme biologiquement active est obtenue après l'établissement d'une configuration spatiale particulière, régie par la présence de certains déchets d'acides aminés dans la structure.
- Le cas de l'apomioglobine
L'apomicoglobine (la myoglobine dépourvue du groupe Hemo) est une petite protéine alpha-hélicoïde qui a servi de modèle pour étudier le processus de pliage et l'importance de ses déchets apolaires dans la chaîne polypeptidique de la même chose.
Dans une étude menée par Dyson et des collaborateurs en 2006 où des séquences mutées d'apomioglobine ont été utilisées, il a été démontré que l'initiation des événements de pliage de cela dépend principalement de His parmi les acides aminés avec des groupes apolaires d'alpha-hélices.
Il peut vous servir: relation entre la matière et l'énergie observée dans la nutrition cellulaireAinsi, de petits changements introduits dans la séquence d'acides aminés signifient des modifications importantes dans la structure tertiaire, ce qui entraîne des protéines mal formées et inactives.
Détergents
Un autre exemple clair est le mode d'action des détergents commerciaux que nous utilisons à des fins domestiques chaque jour.
Les détergents sont des molécules amphipatiques (avec une région polaire et un autre apolaire). Ils peuvent "émulsifier" la graisse car ils ont la capacité de former des liaisons hydrogène avec les molécules d'eau et d'avoir des interactions hydrophobes avec les lipides présents dans les graisses.
Lors du contact avec la graisse dans une solution aqueuse, les molécules de détergent sont associées les unes aux autres de telle manière que la queue apolaire face, en entourant les molécules lipidiques, et sont exposées à la surface du mycela les régions polaires, qui entrent en contact d'eau.
Les références
- Chandler, D. (2005). Interfaces et la force motrice de l'assemblage hydrophobe. Nature, 437(7059), 640-647.
- Dyson, J. H., Wright, P. ET., & Sheraga, H. POUR. (2006). Le rôle des interactions hydrophobes dans l'initiation et la propagation du repliement des protéines. PNA, 103(35), 13057-13061.

