Caractéristiques, structure et fonctions des intégrines
- 1924
- 480
- Anaïs Julien
Le Intégrines Ils sont un grand groupe ou une famille de protéines de surface cellulaire, apparemment exclusives au règne animal. Ils sont la principale ressource des cellules pour maintenir l'interaction (sous forme d'adhésion) avec d'autres cellules et avec la matrice cellulaire.
Sa structure est composée de deux sous-unités appelées Alfa et Beta. Chez les mammifères, il est connu qu'il existe entre 16 et 18 unités alpha et 3-8 bétas, qui agiront en fonction de leur combinaison, ainsi que de l'état physiologique de la cellule ou du tissu spécifique.
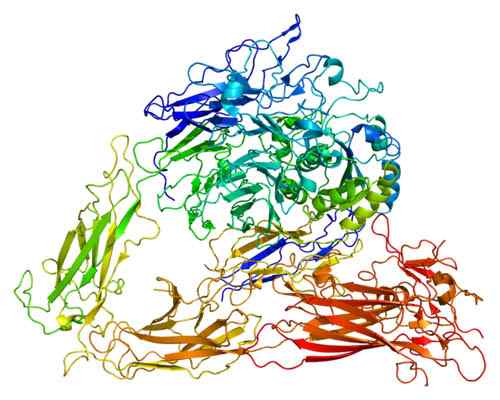 Dessin de la structure moléculaire de la protéine ITGB3 (Integrina Beta 3). Pris et édité à partir de: EMW [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)].
Dessin de la structure moléculaire de la protéine ITGB3 (Integrina Beta 3). Pris et édité à partir de: EMW [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Il existe plusieurs protéines qui ont des fonctions adhésives. Cependant, le groupe d'intégrines est celui qui est le plus distribué et interagit avec toutes les protéines clés de la matrice cellulaire. Les intégrines participent à la phagocytose, à la migration cellulaire et à la cicatrisation des plaies, et sont même très étudiées pour leur participation aux métastases.
[TOC]
Caractéristiques
Ce sont des protéines caractérisées par unir mécaniquement le cytoesquelette cellulaire. Détecter biochimiquement si l'admission a été effectuée ou non et transducts des signaux cellulaires reliant l'environnement extracellulaire à l'intracellulaire, dans les deux sens.
Ils travaillent ou travaillent avec d'autres récepteurs tels que les immunoglobilines, la cadhérine, les sélections et les syndecandos. En ce qui concerne les ligands des intégrines, ceux-ci sont constitués par la fibronectine, le fibrinogène, le collagène et la vitronectine, entre autres.
L'union de ces ligands est due à des cations divalents extracellulaires telles que le calcium ou le magnésium. L'utilisation de l'une ou de l'autre dépendra de l'intégrine spécifique.
Les intégrines ont une forme allongée se terminant par une tête en forme de globe qui, selon les observations de microscopie électronique, est projetée vers plus de 20 nanomètres de la bicouche lipidique.
Structure
 Les intégrines sont des protéines qui permettent la communication entre les cellules.
Les intégrines sont des protéines qui permettent la communication entre les cellules.Source: Berkshire Community College Bioscience Image Library [CC0]
Les intégrines sont des hétérodimères, c'est-à-dire que ce sont des molécules toujours composées de deux protéines. Les deux protéines sont considérées comme des sous-unités ou des protomères et sont différenciées en sous-unité alpha et sous-unité bêta. Les deux sous-unités sont unies de manière non covalente. Ils ont une masse moléculaire entre 90 et 160 kDa.
Le nombre de sous-unités alpha et bêta varie entre les différents groupes d'organismes dans le règne animal. Dans les insectes tels que la mouche des fruits (Drosophyle), par exemple, il y a 5 sous-unités alpha et 2 bêta, tandis que dans les nématodes de genre Chute Il y a2 alfas et une version bêta.
Il peut vous servir: podocytes: caractéristiques, histologie et fonctionsChez les mammifères, les chercheurs suggèrent qu'il existe un nombre fixe de sous-unités et de combinaisons de ceux-ci; Cependant, il n'y a pas de consensus dans la bibliographie concernant ce numéro. Par exemple, certains mentionnent qu'il y a 18 sous-unités alpha, 8 bêta et 24 combinaisons, tandis que d'autres parlent de 16 alpha et 8 bêta pour 22 combinaisons.
Chaque sous-unité présente la structure suivante.
Alpha Subnidad
La sous-unité alpha présente une structure avec un domaine de sept feuilles ou des feuilles qui forment la tête, un domaine dans la cuisse, deux domaines du mollet, un seul domaine transmembranaire et également une courte queue cytoplasmique qui ne présente pas une activité enzymatique ou l'actine syndicat.
Chaînes actuelles avec environ 1000 à 1200 déchets. Peut rejoindre des cations bivalents.
Chez les mammifères, où les intégrines ont été les plus étudiées, la sous-unité alpha peut être regroupée car elle contient ou non un domaine inséré (alpha I).
Avec le domaine inséré alpha I
Le domaine inséré Alpha I se compose d'une région de 200 acides aminés. La présence de ce domaine dans les intégrines indique qu'ils sont des récepteurs de collagène et de leucocytes.
Aucun domaine inséré
Les intégrines alpha qui ne présentent pas le domaine intégré sont classées en 4 sous-radias, que nous verrons ci-dessous.
PS1
Les récepteurs des glucoprotéines, également appelés laminines, sont vitaux pour intégrer les tissus musculaires, les reins et la peau.
PS2
Cette sous-famille est le récepteur d'acide arginylglycilaspartic, également connu sous le nom de RGD ou Arg-Gly-Asp.
PS3
Cette sous-famille a été observée dans les invertébrés, en particulier chez les insectes. Bien que l'on sache peu de choses à ce sujet, il existe des études qui évaluent leur rôle essentiel dans l'activité fonctionnelle de l'intégrine des leucocytes CD11D, chez l'homme.
PS4
Cette sous-famille est connue sous le nom de groupe Alfa 4 / Alfa 9 et comprend des sous-unités avec ces mêmes noms.
Ces sous-unités sont capables de correspondre aux sous-unités Beta 1 et Beta 7. Ils partagent également des ligands très similaires aux sous-unités alpha qui présentent l'alpha I inséré du domaine, telles que les molécules d'adhésion des cellules vasculaires, les ligands sanguins solubles, le fibrinogène et d'autres, y compris même les agents pathogènes.
Il peut vous servir: lymphaopoyèse: caractéristiques, étapes, régulationSous-unité bêta
Structurellement, la sous-unité bêta se compose d'une tête, d'une section appelée tige / jambe, un domaine transmembranaire et une queue cytoplasmique. La tête est composée d'un domaine bêta I, qui est inséré dans un domaine hybride qui se lie au domaine de la plexine-milefora-enteginale, également connu sous le nom de psi.
La section tige / jambe contient quatre modules égaux ou très similaires au facteur de croissance épidermique de l'intégrine riche en cystéine et, comme déjà mentionné, une queue cytoplasmique. Cette queue cytoplasmique, comme dans la sous-unité alpha, n'a aucune activité enzymatique ou Union Actina.
Ils ont des chaînes avec un certain nombre de déchets comprises entre 760 et 790, et peuvent rejoindre, tout comme les sous-unités alpha, les cations bivalentes.
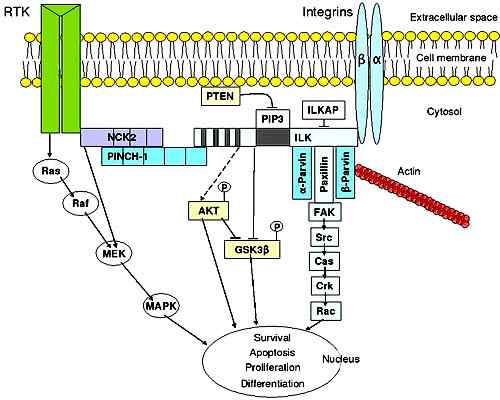 Signalisation de l'intégrine dans les cellules épithéliales. Pris et édité à partir de k.Murphy à Wikipedia en anglais [domaine du domaine public].
Signalisation de l'intégrine dans les cellules épithéliales. Pris et édité à partir de k.Murphy à Wikipedia en anglais [domaine du domaine public]. Les fonctions
Les intégrines ont cependant plusieurs fonctions pour lesquelles elles sont principalement connues, ce sont celles que nous verrons ci-dessous.
Union ou couplage de la cellule à la matrice extracellulaire
La connexion entre la cellule et la matrice extracellulaire grâce aux intégrines favorise la résistance de la cellule à la poussée mécanique, les empêchant d'être déchirés dans la matrice.
Plusieurs études suggèrent que le couplage à la matrice cellulaire est une exigence de base pour le développement d'eucaryotes multicellulaires.
La migration cellulaire est un processus dans lequel les intégrines interviennent par union ou le couplage à différents substrats. Grâce à cela, ils sont impliqués dans la réponse immunitaire et la guérison des plaies.
Transduction du signal de la matrice extracellulaire à la cellule
Les intégrines participent au processus de transduction du signal. Cela signifie qu'ils interviennent dans la réception des informations du liquide extracellulaire, les codifieront, puis l'altération des molécules intracellulaires commence, comme une réponse.
Cette transduction du signal intervient dans un grand nombre de processus physiologiques tels que la destruction cellulaire programmée, la différenciation cellulaire, la méiose et la myitose (division cellulaire) et la croissance cellulaire, entre autres.
Intégrines et cancer
Plusieurs études montrent que les intégrines jouent un rôle important dans le développement des tumeurs, en particulier dans les métastases et l'angiogenèse. Un exemple de cela est les intégrines αvβ3 et α1β1, entre autres.
Peut vous servir: cellule animaleCes intégrines ont été liées à la croissance cancéreuse, avec l'augmentation de la résistance thérapeutique et des néoplasmes hématopoïétiques.
Perspective évolutive
Une adhésion efficace entre les cellules pour former des tissus était, sans aucun doute, une caractéristique cruciale qui aurait dû être présente dans l'avenir évolutif des organismes multicellulaires.
L'émergence de la famille des intégrines a été suivie jusqu'à l'apparition des métazo-il y a environ 600 millions d'années.
Un groupe d'animaux aux caractéristiques histologiques ancestraux est des porifers, communément appelés éponges de mer. Chez ces animaux, l'adhésion cellulaire se produit par une matrice de protéoglycane extracellulaire. Les récepteurs qui se lient à cette matrice ont un motif typique de l'union Integrina.
En fait, dans ce groupe animal, les gènes liés à des sous-unités spécifiques de certaines intégrines ont été identifiées.
Au cours de l'évolution, l'ancêtre des métazoos a acquis une intégrine et une maîtrise de l'union qui a été conservée au fil du temps dans cet immense groupe d'animaux.
Structurellement, la complexité maximale des intégrines est observée dans le groupe vertébré. Il existe différentes intégrines qui ne sont pas présentes dans les invertébrés, avec de nouveaux domaines. En effet, plus de 24 intégrines fonctionnelles différentes ont été identifiées dans l'humain - tandis que dans la mouche des fruits Drosophila Melanogaster Il n'y en a que 5.
Les références
- Intégrine. Clinique de l'Université de Navarra. Récupéré de cun.est.
- Accession. Atlas d'histologie végétale et animale. Récupéré de Mmegias.sites Internet.Uvigo.est.
- B. Alberts, un. Johnson, J. Lewis, et al. (2002). Biologie de la cellule moléculaire. 4e édition. New York: Garland Science. Intégrines. NCBI a récupéré.NLM.NIH.Gouvernement.
- R.L. Anderson, T.W. Owens & J. Matthew (2014). Fonctions structurelles et mécaniques des intégrines. Revues biophysiques.
- Intégrine. Récupéré de.Wikipédia.org.
- Qu'est-ce que l'intégrine? Mbinfo. Récupéré de Mechanobio.Info.
- S. Mac fhearraight & d. Bruce. Le rôle des intégrines dans la signalisation cellulaire. Récupéré d'Abcam.com.
- POUR.S. Berghoff, ou. Rajky, F. Winkler, R. Bartsch, J. Furtner, J.À Hainfellner, s.L. Goodman, M. Weller, J. Schittenhelm, m. Preusser (2013). Modèles d'invasion dans les états des buts du cerveau des cancers solides. Neuro oncologie.
- « Caractéristiques, types et sélections de fonctions
- Caractéristiques de Plumeria rubra, habitat, utilisations, ravageurs »

